Поскольку обнаружение генерализованного отека свидетельствует о крайней тяжести заболевания у плода, следовательно, до внедрения в клиническую практику внутриутробных трансфузий практически все плоды вскоре после выявления ультразвуковых признаков этого синдрома погибали. Этот факт объясняет причину того, что продолжался постоянный поиск других ультразвуковых маркеров гемолитической болезни, способных своевременно выявить у плода прогрессирующую анемию, являющуюся наиболее клинически важным внутриутробным проявлением заболевания, приводящим без своевременного лечения к развитию у плода отека.
По данным одних авторов, отечный синдром у плода начинает развиваться с отека передней брюшной стенки. По данным других авторов, первым ультразвуковым признаком развивающегося отека у плода является двойное контрастирование стенок полых органов.
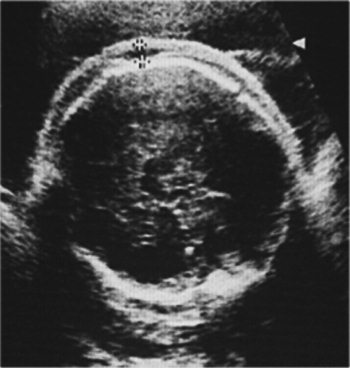
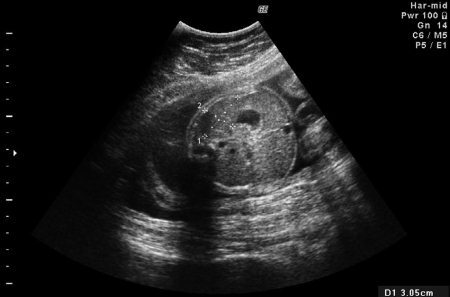
Рис. 6. Двойной контур (отек) вокруг головы плода при отечной форме гемолитической болезни
Установлено, что эффект двойного контрастирования полых органов появляется при накоплении в брюшной полости перитонеальной жидкости в объеме 30 мл.
В последующем, при нарастании выпота и развитии анасарки, начинает появляться отек вокруг тела и головы плода, формируя у него типичное «лицо Будды» (рис. 6, 7).
Не было установлено связи между местом выявления у плода отека и тяжестью гемолитической болезни. Большинство исследователей считают, что общий отек туловища не бывает без асцита. Однако перикардиальный выпот при этом может отсутствовать.
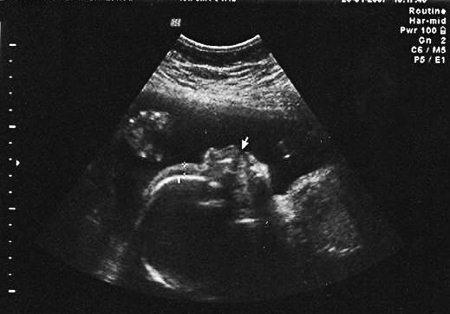
Рис. 7. Подкожный отек лица у плода при отечной форме гемолитической болезни
При увеличении отека сначала визуализируется повышенное количество перитонеальной жидкости между петлями кишечника, а в тяжелых случаях определяется значительная прослойка жидкости между брюшной стенкой и петлями кишечника. Считают, что подобная прослойка начинает визуализироваться при наличии в брюшной полости плода уже около 50 мл свободной жидкости.
Значимый асцит визуализируется у плода при наличии в брюшной полости свободной жидкости в объеме более 100 мл (рис. 8 А, Б на стр. 66).
Выпот в плевральной полости – гидроторакс (рис. 9 А, Б) наблюдается у плода, как правило, значительно реже по сравнению с асцитом и является вторичным по отношению к нему. Гидроторакс ряд авторов рассматривает как неблагоприятный прогностический признак.
В тяжелых случаях отека развивается гидроперикард, диагноз которого устанавливается на основании выявления анэхогенной прослойки в сердечной сумке плода толщиной более 4 мм (рис. 10 на стр. 67).
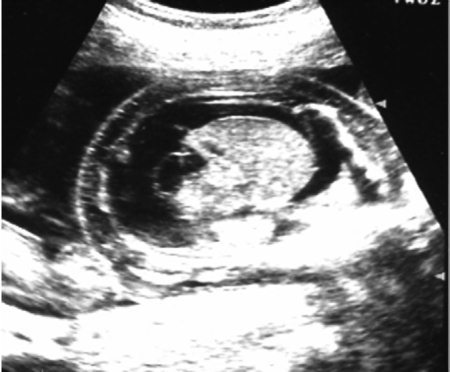
Рис. 9. Гидроторакс у плода при отечной форме гемолитической болезни
G.R. DeVore и соавторы (1985) предложили использовать регистрацию перикардиального выпота, выявленного при ультразвуковом исследовании в М-режиме, в качестве раннего маркера тяжелой анемии у плода и показания к внутриутробному лечению. Однако нельзя забывать, что рандомизированных исследований в этом направлении не проводилось, а ультразвуковые приборы с высокой разрешающей способностью дают возможность визуализировать небольшое количество перикардиальной жидкости и у здоровых плодов. Поэтому большое значение придают количественной оценке толщины перикадиального выпота.
Предлагается считать диагностически значимым увеличение полости перикарда свыше 4 мм, так как именно такой показатель обычно сочетается с другими признаками гемолитической болезни плода. Большой объем перикардиального выпота имеет серьезное прогностическое значение и может влиять на тактику лечения плода. В таких случаях следует уменьшить объем трансфузии плоду, поскольку увеличивается риск развития тампонады его сердца вследствие гиперволемии.
Плевральный выпот, по данным современной литературы, встречается значительно реже, чем гидроперикард, и должен рассматриваться как прогностически плохой признак.
Объем перикардиального выпота нарастает с увеличением тяжести анемии и сопровождается ультразвуковыми признаками сердечной недостаточности. Формируется кардиомегалия, увеличивается минутный сердечный выброс, наблюдается гипертрофия желудочков: их диаметр увеличивается более чем в 1,1 раза к норме для срока беременности. Кроме того, усиливается коронарный кровоток.
Отечный синдром встречается у плодов, имеющих тяжелую анемию. Это подтвердили и исследования, проведенные в НИИАГ им. Д. О. Отта СЗО РАМН. Так, по данным А. В. Михайлова (1999), гематокрит крови плодов, имевших отек, как правило, не превышал 13 %.
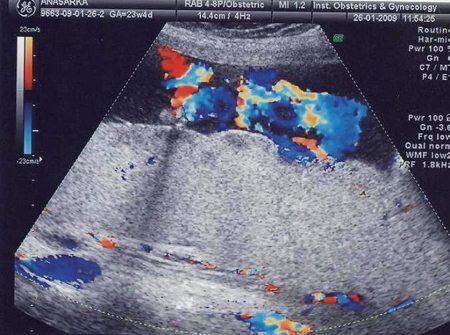
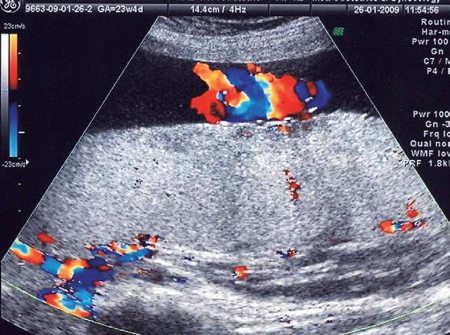
Рис. 5. Увеличение толщины и изменение структуры плаценты при тяжелой желтушно-анемической форме гемолитической болезни
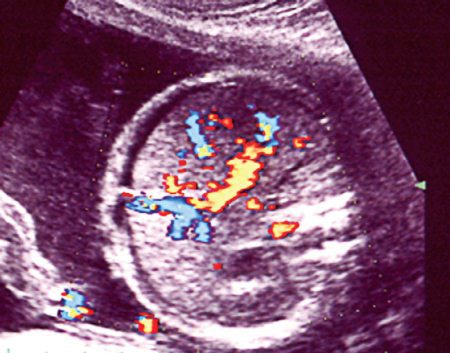
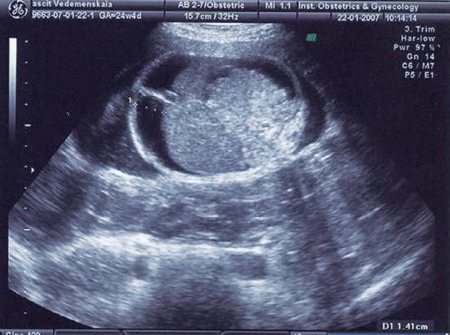
Рис. 8. Асцит у плода при отечной форме гемолитической болезни
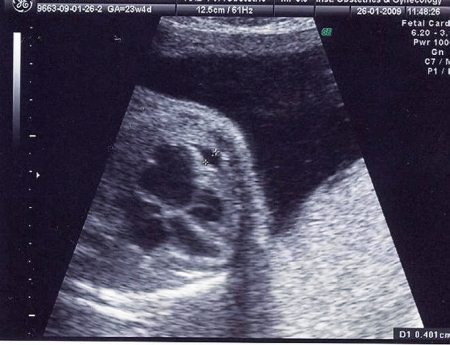
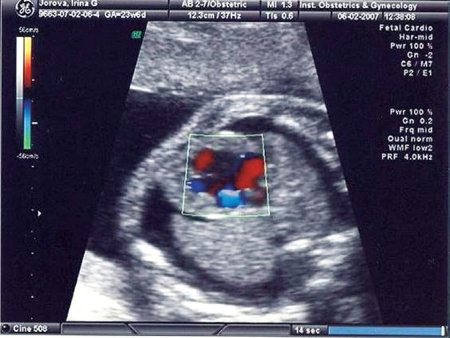
Рис. 10. Гидроперикард у плода при отечной форме гемолитической болезни
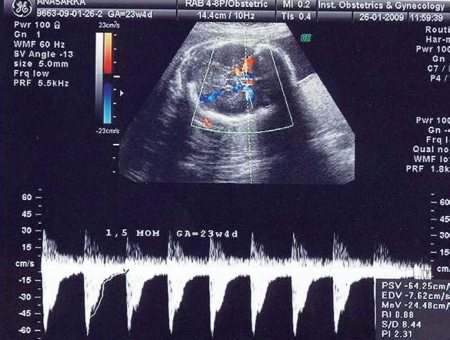
Рис. 15. Допплерометрия с цветовым допплеровским картированием (ЦДК) мозгового кровотока плода. Кривая скорости кровотока в средней мозговой артерии. Определение максимальной систолической скорости (МСС)
Известно, что начиная с 8-й недели беременности, основным кроветворным органом у плода является печень. Еще одним важным органом, обеспечивающим эритропоэз у плода с 18 недель и до окончания беременности, является селезенка. В третьем триместре беременности эту функцию в основном принимает на себя костный мозг.
Поскольку гемолитическая болезнь сопровождается гемолизом эритроцитов плода с последующей активацией экстрамедуллярного кровообращения, данные ультразвуковой биометрии у плода, страдающего аллоиммунной анемией, должны свидетельствовать об увеличении размеров печени и селезенки. Спленомегалия, кроме того, может объясняться быстрым разрушением покрытых комплексами антиген-антитело эритроцитов, преимущественно протекающим в селезенке.
Непосредственно измерение размеров печени плода первоначально было предложено В. Н. Демидовым (1981). Автор предлагал оценивать ее размеры у плода по косвенным признакам – изменению формы и смещению желудка, увеличению периметра живота и расположению нижнего края печени плода ниже гребня подвздошной кости при продольном сканировании. В последующем А. В. Михайлов (1990) предложил способ расчета объема печени плода по разработанной им формуле. Однако этот метод трудно воспроизводим и не получил широкого распространения.
По данным некоторых исследователей, определение размеров селезенки с высокой чувствительностью (100 %) и специфичностью (94,7 %) можно использовать для прогнозирования развития анемии у плода: вертикальный, продольный, сагиттальный размеры и периметр селезенки прямо коррелируют с показателями оптической плотности околоплодных вод. Однако эта корреляция отсутствует, если у плода наблюдается тяжелая форма заболевания.
D. Oepkes и соавторы (1993) показали, что тяжесть заболевания у плода прямо коррелирует с периметром его селезенки. Однако, как показал С. R. Harman (1989), измерение периметра этого органа технически трудоемко, поэтому результаты исследований вариабельны, а, следовательно, метод не может быть рекомендован для скрининга.
Долгое время считали, что измерение размеров печени в парасагиттальной плоскости, а также периметра селезенки в поперечном сечении у плодов, не имеющих отека, могут быть полезны для диагностики у плода анемии. При гепатоспленомегалии нижний край печени плода определяется справа ниже гребня подвздошной кости, а селезенка выступает ниже края левой реберной дуги более чем на 2 см (рис. 11 А, Б).