Пастер был убежден (и оказался прав), что только в живых организмах можно обнаружить асимметричные вещества, состоящие из асимметричных молекул одного типа. Это была, по его мнению, единственная «четко установленная демаркационная линия, которую можно в настоящее время провести между химией живой материи и химией неживого».
«Неживые симметричные силы, — писал Пастер, — действующие на симметричные атомы и молекулы, не могут привести к появлению асимметрии, поскольку одновременное создание двух асимметричных половинок эквивалентно образованию симметричного целого независимо от того, будут ли асимметричные половинки объединяться в одну молекулу... или существовать в виде разных молекул подобно левой и правой компонентам рацемической кислоты. В любом случае симметрия „целого“ подтверждается отсутствием у него оптической активности».
В трогательном письме к другу в 1851 году Пастер писал (цитирую снова по книге Дюбо): «Я на пороге тайны, и покров, ее скрывающий, становится все тоньше и тоньше. Ночь кажется мне слишком долгой». Последней фразой Пастер хотел сказать, что он с трудом мирится с ночными перерывами в работе, так не терпится ему снова очутиться в своей лаборатории!
Пастер никак не мог установить точную геометрическую природу асимметрии, из-за которой молекулы отличались от своих зеркальных изображений, но в том, что такая асимметрия существует, он не сомневался. «Молекулярные структуры двух винных кислот асимметричны, — писал он, — а в остальном они совершенно одинаковы, только обладают асимметрией разного знака. Группируются ли атомы правой кислоты в виде правой спирали, помещаются ли в вершинах неправильного тетраэдра или образуют асимметричную конструкцию другого типа? Мы не можем ответить на эти вопросы. Но нет никакого сомнения в том, что какой-то асимметричный порядок расположения атомов, несовместимый со своим зеркальным изображением, существует. Не менее достоверно то, что атомы левой кислоты располагаются в противоположном асимметричном порядке».
Истинная природа молекулярной асимметрии была выяснена лишь в 1874 году (Био к тому времени уже не было в живых, а Пастеру исполнилось 52 года). Как часто случается в науке, правильное объяснение было выдвинуто одновременно и независимо двумя людьми: французом Жозефом Ле Белем и голландцем Якобом Гендриком Вант Гоффом. Оба молодых ученых предположили, что атом углерода в различных соединениях углерода помещается в центре тетраэдральной структуры и соединяется химическими связями с четырьмя другими атомами, помещенными по вершинам тетраэдра. Атом углерода имеет всего четыре электрона во внешней оболочке, хотя там достаточно места для восьми. Поэтому у него есть, так сказать, четыре пустых места, которые могут быть заполнены электронами с внешних оболочек четырех других атомов. Если все четыре внешних атома разные, рассуждали Ле Бель и Вант Гофф, то такая тетраэдральная структура будет асимметрична и несовместима со своим зеркальным изображением.
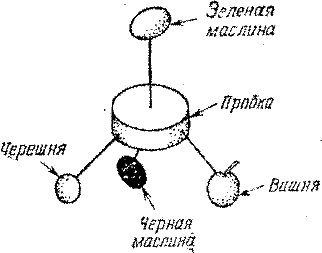
Айзек Азимов в главе об углероде в своей книге «Что должен знать о науке интеллигентный человек» предлагает простой способ изготовить модель тетраэдрального углеродного соединения. Пусть пробка в центре изображает атом углерода. К ней четырьмя зубочистками можно так прикрепить черные маслины, чтобы образовался тетраэдр (рис. 32). Маслины представляют четыре остальных атома одного и того же элемента. Если, например, каждую маслину считать за атом водорода, то получится модель молекулы метана СН4, то есть болотного газа. Это означает, что молекула метана состоит из четырех атомов водорода, химически связанных с одним атомом углерода. Вспомним, что у атома углерода на внешней оболочке есть место для четырех электронов. Каждый атом водорода имеет по одному электрону, так что вчетвером им легко соединиться с углеродом. Если водород соединяется с углеродом, получающиеся соединения называются углеводородами. Молекула метана — простейшая из всех углеводных молекул; это практически простейшая органическая молекула. Во времена Пастера ее изображали (и сейчас изображают) с помощью схематического рисунка, на котором химические связи символизируются черточками, соединяющими четыре буквы Н (водород) с буквой С (углерод). Чертежик этот, конечно, заключен в плоскости.
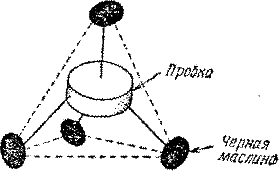
Когда Ле Бель и Вант Гофф попробовали представить себе, как выглядит эта конфигурация в 3-пространстве и какую структуру она должна иметь при этом, на ум им сразу же пришел тетраэдр — простейшее из пяти Платоновых тел, описанных в предыдущей главе, поскольку в нем все водородные атомы будут располагаться на равных расстояних от центрального атома углерода. Ясно, что такая молекула симметрична. У нее даже много плоскостей симметрии. Ее можно совместить с отражением в зеркале.
Предположим теперь, что мы заменили одну черную маслину зеленой. Симметрична ли модель теперь? Да, у нее три плоскости симметрии, и все они проходят через зеленую маслину. Одна такая плоскость показана на рис. 33. Такая модель все еще может быть совмещена со своим зеркальным изображением. Подобную конфигурацию имеет метанол, или древесный спирт. Формулу СН3ОН этого простейшего спирта схематически представляют следующим образом:
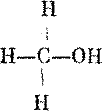
Уберем еще одну черную маслину и заменим ее вишней. С первого взгляда может показаться, что симметрия модели нарушена, но, посмотрев внимательнее, вы убедитесь, что модель все еще симметрична.
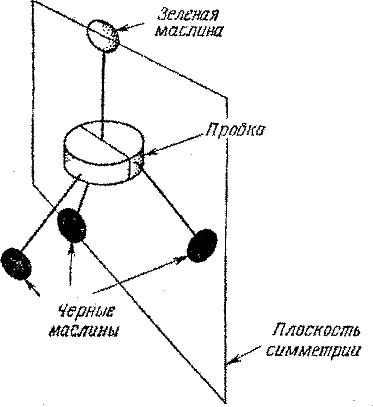
Упражнение 10. Проведите плоскость симметрии через модель, изображенную на рис. 34.
Молекула этилового, или винного, спирта (С2Н5ОН) имеет подобное строение. На приведенной ниже схеме молекулы этилового спирта атом углерода связан с двумя атомами водорода, которые, конечно, однородны; две другие связи соединяют разнородные группы атомов.
Если по крайней мере две группы атомов, связанные с центральным атомом углерода, одинаковы, то молекула симметрична. Но если вы удалите еще одну черную маслину и замените ее белой черешней, симметрия, наконец, нарушится (рис. 35). Теперь у модели нет плоскости симметрии. Как бы ни вращали вы эту модель в 3-пространстве, совместить ее с зеркальным изображением не удастся.
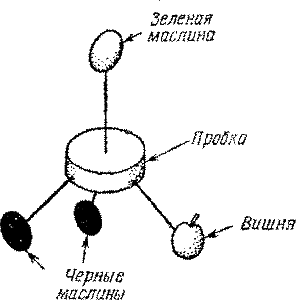
Молекулой такого типа обладает амиловый спирт, вот ее структурное изображение:
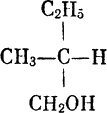
Как видите, все группы, с которыми соединяется центральный атом, разные. Когда это случается, атом углерода называют асимметричным атомом С. Конечно, сам по себе атом углерода не асимметричен; асимметричен он только в том смысле, что связан с четырьмя другими атомами или группами атомов таким образом, что возникает асимметричная в 3-пространстве конструкция. Любая молекула, содержащая один или несколько асимметричных атомов углерода, является обычно асимметричной. Исключением служат случаи, когда взаимно зеркально асимметричные атомы уравновешивают друг друга, так же как наши уши уравновешивают друг друга. Примером служит четвертая разновидность винной кислоты, так называемая мезовинная кислота.
Схемы на рис. 36 поясняют, чем отличается мезовинная кислота от остальных трех разновидностей. Правая винная кислота содержит два асимметричных атома углерода — оба с правосторонней ориентацией.