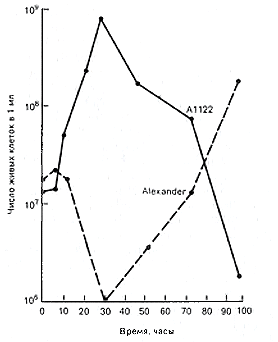
Рис. 10. Рост штаммов Alexander (вирулентный) и А1122 (авирулентный) Y.pestis при температуре 37 °C в аэрируемой жидкой синтетической среде с глюкозой в качестве источника энергии [Wessman G. Е. et al., 1958].
По данным G. M. Fukui и соавт. [1960], из числа известных тогда детерминантов вирулентности, «главные» имели лишь культуры, которые выращивали при температуре 37 °C; они же обладали наиболее высокой вирулентностью (табл. 16). Однако, когда культуры, выращенные при 5 °C, подвергали инкубации при 37 °C и аэрации, то уже через 2 ч. вирулентность бактерий значительно увеличивалась, а через 8 ч. возрастала на два логарифма. Все это протекало на фоне отсутствия заметного увеличиения числа жизнеспособных клеток, что говорило о фенотипической модуляции вирулентности. Сходные результаты были получены и в опытах с морскими свинками.

Примечание. В скобках указан доверительный интервал для вероятности 95 %.
В работе H. B. Naylor и соавт. [1961] описаны условия, необходимые для восстановления вирулентности у «5-градусных» культур: инкубация в течение 6 ч. с аэрацией при 37–41 °C; наличие в среде ряда аминокислот, сбраживаемого сахара (ксилозы) и неорганического фосфата, присутствие глюконата, pH среды в пределах 5,5–8,4. Немаловажно, что к числу «восстанавливающих» факторов ионы кальция не относились!
Как уже указывалось [Домарадский И. В., 1993], на основании многочисленных данных создается впечатление, что столь поразительная связь между температурой и свойствами чумного микроба может быть следствием тех двух фаз существования его в природе, которые постулировал М. Балтазар [1964]; находя у теплокровных животных все, в чем он нуждается, микроб теряет свою относительную неприхотливость, необходимую для персистенции во внешней среде, и переключает метаболизм на синтез факторов, позволяющих противостоять защитным силам организма. Поэтому приходится сожалеть, что, интимные механизмы поразительного влияния температурного фактора на различные стороны физиологии чумного микроба выпали из поля зрения исследователей и остаются нерасшифрованными. По нашему мнению, здесь следовало бы в первую очередь попытаться выяснить, в чем заключается специфика регуляции ферментативной активности чумного микроба, и осуществляется ли она при критических ситуациях путем изменения количества ферментов («дирижеров» ключевых реакций) на уровне транскрипции или происходит за счет изменения их активности, т. е. степени изменения каталитического потенциала клетки.
У всех иерсиний были обнаружены V- и W-антигены, но сначала их нашли у чумного микроба [Burrows T. W., Bacon G. A., 1956b],
Как считают, оба эти антигена вместе с FI или независимо от неё обладают антифагоцитарным действием и рассматриваются поэтому как факторы вирулентности чумного микроба. Фагоцитозу могут противостоять даже авирулентные VW+ штаммы, лишенные FI, а сыворотка против этих антигенов устойчивость чумного микроба к фагоцитозу снижает [Burrows T. W., Bacon G. A., 1956a]. C другой стороны, имеются указания на то, что V-антигенучаствует в процессах иммуносупрессии путем торможения синтеза цитокинов [Nakajama R. et al., 1995] Недавно получены также весьма убедительные доказательства значения V-антигендля иммунитета против чумы. Выяснилось, в частности, что рекомбинантный V-антиген защищает мышей от заражения вирулентным штаммом чумного микроб [Leary S. et al., 1995].
Что касается W-антигена, то он может играть роль порина, способствующего выходу V антигена в окружающую среду, но в общем о нём мало что известно.
По данным W. D. Lawton и соавт.[1963], V-антигенявляется белком с мол. массой 90 кДа, а W представляет собой липопротеин с мол. массой 145 кДа. Оба антигена стабильны как при 60(С (30 минут), так и в замороженном состоянии, но инактивируются при 80(С, длительном хранении при 5(С и лиофилизации. В процессе диализа против дистиллированной воды разрушается только W-антиген.
V- и W-антигены содержатся в цитоплазматической фракции микроба. S. C. Straley и R. Brubaker [1982] изолировали пептиды, связанные с этими детермиантами вирулентности, путем разрушения клеток и разделения компонентов цитоплазмы и внешней мембраны. Благодаря тому, что эти антигены на поверхности не экспрессируются, предполагают, что с клеточными мембранами клеток хозяев они не взаимодействуют.
Подобно другим белкам, о которых говорилось в предыдущем разделе, V- и W-антигены кодируются плазмидой pCad и экспрессируются только во время стаза; их синтез при делении клеток в присутствии избытка ионов кальция подавляется. Тем не менее считают, что после захвата бактерий фагоцитами оба антигена синтезироваться все же могут, так как в фаголизосомах концентрация кальция достаточно низка [Pollack et al., 1986].
Синтез V-антигена кодируется геном lcrV, входящим в состав оперона lcrGVH-yopBD, расположенном на плазмиде «вирулентности» [Bergman T. et al.,1991; Perry R. D. et al., 1986;].
По данным S. Price и соавт. [1991], V-антиген является регуляторным бифункциональным белком, С одной стороны, он необходим для кальций-зависимого роста чумного микроба, а с другой (для максимальной экспрессии LCR-генов вирулентности.
Говоря о Vwa, нельзя не вернуться к другим белкам, связнным с LCR, которые также относят к белкам вирулентности иерсиний. Все они относятся к числу поверхностных белков и выполняют разные функции в патогенезе инфекций: сигнализируют микробным клеткам о наличии ионов кальция (YopN) и изменении температуры (LcrF), выполняют ферментативные и регуляторные функции (YpkA, YopH), образуют поры в соответствующих клетках-мишенях и способствуют перемещению в них других белков ((YopK,YopB,YopD), дают цитотоксический эффект (YopE), нарушают агрегацию тромбоцитов (YopM) и др. [Guan K., Dixon J, 1990; Leung K. Y. et al.,1990; Bliska J. B. et al., 1991; Forsberg A. et al., 1991; Galyov E. et al., 1993; Holmstr(m A, 1995]. Из числа белков, кодируемых плазмидой pCad и участвующих в LCR, у чумного микроба выявлено 11, среди которых превалируют YopM и YopN [Leung K. Y. et al., 1990]. Одна из причин, с которой может быть связан относительно небольшой набор LCR-белков у чумного микроба, рассматривается ниже.
Поскольку синтез всех LCR-белков неразрывно связан с pCad, необходимо заострить внимание на очень важном факте, который может помочь лучше понять, от чего зависят флюктуации вирулентности чумного микроба. Мы имеем в виду данные R. Zsigray и соавт. [1983,1985], показавших, что у штаммов Y. pestis, получивших F' lac, потеря вирулентности обусловливается встройкой pCad в хромосому. Встройка носит обратимый характер: pCad возвращается в автономное состояние, когда F' lac элиминируется из клеток.
Подобно многим другим микроорганизмам чумной микроб in vivo и при определенных условиях in vitro образует капсулу или оболочку. Однако, как подчеркивал T. Burrows (1960a), по вопросу о том, идентична ли капсула, образуемая микробом в организме, капсуле, которая образуется им на искусственных питательных средах, мало что известно.
Начало интенсивному изучению капсульного вещества было положено работами. E. E Baker и соавт. [1952]. которые для её извлечения использовали водносолевой экстракт сухих клеток чумного микроба[12].
На искусственных питательных средах максимальное количество FI в форме видимой капсулы накапливается при 37(С. При температуре 26–28 (C, оптимальной для роста чумного микроба, образование FI выражено значительно слабее.
12
Водно-солевой экстракт содержит, помимо FI и FII, полисахаридно-липидный комплекс. Первый состоит из галактозы и фукоэы, а во второй входят фосфатидилэтаноламин и фосфатидилсерин [Glosnicks R., Cruzkiewicz Е., 1980].