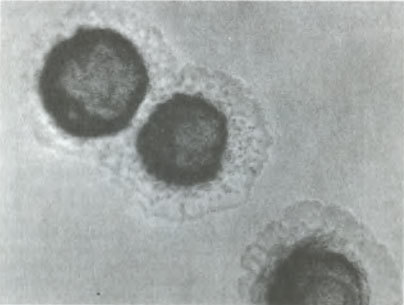
Рис. 8. Двухсуточные колонии чумного микроба, х 32.
В бульоне обычно образует хлопьевидный или порошковидный, легко распадающийся при встряхивании осадок, жидкость над ним остается прозрачной. Часто образует нежную пленку; в старых культурах от неё вглубь среды могут отходить нити — «сталактиты» (рис. 9).

Рис. 9. Старая бульонная культура чумного микроба. Хорошо видны «сталактиты» |Wu Lien-Teh et al., 1936].
В связи с относительной неприхотливостью Y. pestis растёт на синтетических средах с аминокислотами (в качестве источников азота) и ферментируемыми углеводами. В витаминах и азотистых основаниях, как правило, не нуждается. Однако аминокислотные потребности у штаммов из разных природных очагов сильно варьируют. Кроме того, они могут меняться в зависимости от температуры культивирования. В связи с этим следует подчеркнуть неоднородности популяций чумного микроба по аминокислотным потребностям, которая безусловно имеет определенную биологическую целесообразность. Весьма вероятно, что при неблагоприятных условиях внешней среды возбудитель чумы может выживать не только за счёт появления прототрофных мутантов, но и благодаря синтрофизму между ауксотрофными мутантами, отличающимися по потребности в аминокислотах [Лебедева С. А. и др., 1970].
Факультативный анаэроб. Для роста из небольших посевных доз на плотных средах нуждается в понижении окислительно-восстановительного потенциала, достигаемом, в частности, за счёт добавления сульфита натрия, крови или гемина. На жидких средах хорошо развивается при аэрации. Оптимум температуры роста — 26–28 °C, пределы — от (2 до + 45 °C. Оптимум pH 7,0–7,2, пределы — 5,0–9,5.
Чаще образует бактериоцин (пестицин I), свертывает плазму крови и вызывает фибринолиз. Мочевину обычно не разлагает (см. стр. 55). Индол и ацетилметилкарбинол не образует. Продукция сероводорода бывает на жидких средах с ферментируемыми сахарами. Дает положительную реакцию на аммиак и обычно с метиловым красным. Метиленовую синь редуцирует редко. Нитраты чаще востанавливаает до нитритов. Каталазу и оксидазу образует. Декарбоксилирует аргинин и нерегулярно гистидин. Углеводы и их производные ферментирует до кислоты без газа (табл. 11).

Примечание. Отношение чумного микроба к глицерину и рамнозе зависит от происхождения штаммов.
Содержание Г+Ц в ДНК равно 46 % (по температуре плавления).
В чистых культурах Y. pestis высокочувствительна к обычным дезинфектантам. Отличается небольшой устойчивостью в окружающей среде; чувствительна к высушиванию, особенно при резких колебаниях влажности; быстро погибает под действием солнечных лучей. В мокроте и крови остается жизнеспособной значительно дольше. Низкую температуру переносит хорошо, в замерзших трупах сохраняется несколько месяцев.
Чумной микроб чувствителен ко многим сульфаниламидным препаратам и антибиотикам, но резистентен к пенициллину (образует пенициллиназу).
Закончив общую характеристику тинкториальных и культурально-биохимических свойств Y. pestis, остановимся на некоторых наиболее важных, с нашей точки зрения, аспектах ее биологии.
3.2. Морфологические особенности
Клетка Y. pestis построена по типу, присущему клеткам всех грамнегативных бактерий, но отличается рядом особенностей [Кац, Л. Н., 1966; Голубиниский Е. П. и др., 1971; Наумов А. В., Самойлова Л. В., 1992]. Скелет клетки, представленный трехслойной мембраной, придает клетке овоидную форму со вздутьями по бокам и закруглениями на концах. Средний слой отличается способностью интенсивно абсорбировать красители на полюсах клетки (столь типичная для чумного микроба биполярная окраска обусловливается именно этим). Структурную основу внешней мембраны клеточной стенки составляет липополисахаридно-белковый комплекс, однако у чумного микроба липополисахарид (ЛПС) подобен ЛПС R-мутантов грамотрицательных бактерий, чем, в частности, объясняются характерные особенности роста Y. pestis на искусственных питательных средах [Бахрах Е. Э.,1973; Тараненко Т. М., 1988]. На поверхности клеточной стенки при надлежащих условиях культивирования микроба выявляются пилеобразные или фимбриоподобные структуры, имеющие белковую природу [Водопьянов С. О. и др., 1985; Linder L. E. et al., 1990]
После выращивания при температуре 37 °C и в мазках из органов животных клетки окружены гликопротеидной капсулой.
3.3. Метаболизм
По типу метаболизма все иерсинии, включая чумной микроб, характеризуются как типичные представители семейства кишечных бактерий. Прежние наши возражения против подобного заключения были основаны на иных подходах к таксономии бактерий. Нам казалось, что при классификации микробов нужно исходить из экологического принципа, который учитывает все особенности, а не ограничиваться анатомо-физиологическими данными о бактериях [Домарадский И. В., 1971]. Впрочем, мы и теперь так считаем и если все же мы говорим, что Yersinia являются типичными представителями семейства Enterobacteriaceaе, то, во-первых, следуем устоявшейся традиции, а, во-вторых, хотим подчеркнуть присущую всем членам этого семейства специфику обмена веществ (и только!). Вместе с тем, мы снова подчеркиваем, что по крайней мере Y. pestis, по характеру обитания в природе, а также патогенезу и механизму передачи вызываемой в естественных условиях инфекции на «кишечные» бактерии никак не похож.
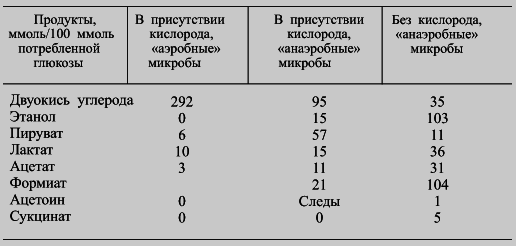
Большое значение для физиологии чумного микроба имеет гликолиз — универсальный и в тоже время филогенетически наиболее древний путь метаболизма углеводов. Об этом свидетельствуют, как данные табл. 11, так и сведения о конечных продуктах диссимиляции углеводов (табл. 12) и наличии у него соответствующих ферментов. Катаболизм других углеводов и близких к ним соединений обычно начинается с превращения в субстраты, доступные для сбраживания. Примечательно, что Y. pestis присуща способность не только к анаэробному, но и к аэробному гликолизу, энергетически более выгодному, чем первый. Не есть ли все это следствие «солидного» возраста возбудителя чумы, ставшего им еще задолго до появления человека, в мезозое, т. е на заре царства млекопитающих — единственных хозяев микроба?
Что касается окисления моносахаридов до двуокиси углерода с промежуточным образованием пентозо- и гептозофосфтов (гексозомонофосфатный путь или пентозный цикл), то его удельный вес в метаболизме чумного микроба весьма невелик, хотя, по-видимому и достаточен для обеспечения его пентозами для образования нуклеиновых кислот [Рублев Б. Д., Голубинский Е. П., 1971]. Низкую активность этого цикла связывают с отсутствием у чумного микроба глюкозо-6-фосфат дегидрогеназы, отличающее его от возбудителя псевдотуберкулёза [Mortlock R., Brubaker R., 1962].
Помимо гликолиза, источником энергии для чумного микроба является окисление глюконата по схеме Энтнера-Дудорова, что установлено R. Mortlock [1962] и подтверждено мною и моими коллегами [Рублев Б. Д. и др., 1971]. Однако как и для других аэробных микоорганизмов, основным источником энергии для чумного микроба служит цикл Кребса. При этом обращает на себя внимание то, что ему присущ даже глиоксилатный цикл, который используется в качестве источника метаболитов для синтеза углеродных скелетов углеводов, причём для этого он обладает несколькими формами изоцитрат-лиазы [Hiller S., Charnetzky W., 1981].