«среди многочисленных зданий научных теорий, воздвигнутых в XIX веке, был похож на обелиск, покрытый непонятными письменами; расшифровать эти письмена — вот великая задача, которую девятнадцатый век оставил в наследство двадцатому».
Приведём ещё периодическую таблицу элементов в том виде, который она имела в тридцатых годах. Заметим, что предсказания свойств новых элементов на основании периодического закона неоднократно делались и впоследствии; так, например, У. Рамзай, после открытия (им и Дж. У. Рэлеем) аргона и гелия, предсказал существование неона, криптона, ксенона, которые он потом и открыл вместе с Траверсом в 1898 году.
Нет ничего невозможного в том, что в природе существуют и элементы, обладающие большей атомной массой, чем уран.
Периодическая таблица элементов Менделеева (первая половина 30-х гг. XX века).
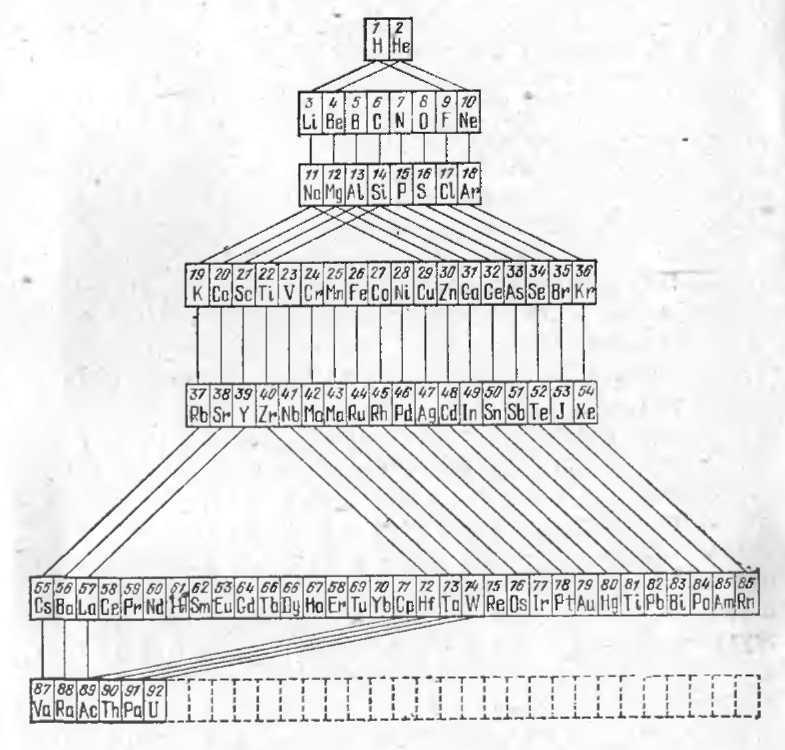
Эти элементы, если они существуют, должны были бы в нашей таблице попасть на места, идущие после урана. Но до сих пор эти элементы ещё не были обнаружены в природе [8]).
Таково, в общих чертах, учение об атомах химических элементов, созданное Дальтоном и определившее всё дальнейшее развитие химии в XIX столетии. Но если гипотеза об атомах и молекулах оказалась такой важной и такой полезной для химии, то какую роль она сыграла в физике, занимающейся гораздо более широкой областью явлений природы, чем химия? Следует заметить, что в физике гипотеза атомов существовала и играла очень большую роль задолго до той поры, когда Дальтон сделал учение об атомах и молекулах необходимым для того, чтобы хоть что-нибудь понимать в химических явлениях. Ведь мы уже говорили о том, как и к теории атомов относился такой гениальный и авторитетный физик, как Исаак Ньютон. Представление об атомах служило физикам для того, чтобы составить ясное понятие о целом ряде физических явлений. Мы нагреваем тело — это тело расширяется. С точки зрения атомной гипотезы это значит, что атомы несколько отошли друг от друга — пустые промежутки между ними увеличились. Как можно было бы наглядно представить себе такое простое явление, как расширение тел при нагревании, если считать вещество не состоящим из атомов, а непрерывный и сплошным? Все газы обладают гораздо меньшей плотностью, чем жидкости и твёрдые тела, — это значит, что атомы (или молекулы) газов находятся на очень больших расстояниях друг от друга; поэтому-то так легко сжать газ, т. е. уменьшить пустые промежутки между его атомами или молекулами. Сжать сколько-нибудь заметно жидкость или твёрдое тело очень трудно, а уменьшить посредством сжатия объём жидкого или твёрдого тела в несколько раз вовсе невозможно. Что это значит? Это значит, что в жидких и твёрдых телах между атомами почти нет пустых промежутков; атомы почти соприкасаются друг с другом, как дробинки в мешочке с дробью, если его хорошенько встряхнуть.
Всякий газ давит изнутри на поверхность стенок того сосуда, в котором этот газ заключён. Как это понять? Очень просто: стоит только предположить, что атомы (или молекулы) газа не находятся в покое, а, напротив, всё время очень быстро движутся. Если это так, то они должны всё время наталкиваться на стенки сосуда и отскакивать от них, как отскакивают бильярдные шары от борта бильярда; стенки сосуда, в котором заперт газ, должны всё время испытывать изнутри целый град толчков, целую бомбардировку со стороны молекул газа. Если увеличить объём сосуда, отодвинув в нём крышку или поршень, или если открыть перед молекулами газа дверь, ведущую в соседнее пустое пространство, то быстро движущиеся молекулы сейчас же начнут проникать в предоставленный им новый объём, пока весь сосуд не заполнится газом равномерно и целиком. Вот почему всякий газ всегда стремится расшириться и заполнить весь предоставленный ему объём. Легко понять, что будет, если сжать газ, находящийся в каком-нибудь сосуде с поршнем: молекулы газа, занимавшие раньше большой объём, теперь вынуждены будут сконцентрироваться в меньшем объёме, а поэтому на каждый квадратный сантиметр поверхности стенки будет приходиться в течение секунды больше ударов молекул, т. е. молекулярная бомбардировка на каждый квадратный сантиметр стенки возрастает. Давление газа, запертого в сосуде, увеличивается при уменьшении объёма этого сосуда. Если нагреть газ, запертый в сосуде, не изменяя его объёма, то давление газа, как показывают опыты, возрастает. Так как число атомов и молекул осталось тем же самым, то для того, чтобы понять, почему молекулярная бомбардировка увеличилась, необходимо допустить, что при повышении температуры молекулы и атомы начинают двигаться быстрее: вследствие увеличившейся скорости их движения возрастёт и число ударов в секунду о стенку (ведь при возросшей скорости каждая молекула успевает в течение секунды большее число раз слетать от одной стенки сосуда до другой и обратно) и, кроме того, возрастёт и сила каждого отдельного удара. Это допущение о том, что при повышении температуры скорость движения атомов и молекул растёт, должно относиться не только к газам, но и к жидкостям, и к твёрдым телам: без этого невозможно понять, каким образом при нагревании происходит испарение.
В самом деле, как должны мы наглядно представлять себе твёрдые тела и жидкости? Жидкости очень подвижны и текучи; это значит, что атомы и молекулы жидкостей, всё время тесно соприкасаясь друг с другом, вместе с тем легко и быстро скользят, перемещаясь по всему объёму жидкости (иногда бывает, что молекула какой-нибудь жидкости так же легко и просто может перемещаться среди молекул другой жидкости; вот почему так быстро происходит, например, перемешивание воды и спирта, если спирт налит поверх воды в какой-нибудь сосуд).
Твёрдые тела, наоборот, имеют некоторую упругость, т. е. стремятся всё время сохранить свою форму; поэтому приходится заключить, что атомы твёрдых тел всегда находятся в каких-то определённых положениях равновесия и могут только совершать около этих положений более или менее быстрые колебания. Быстрота движений, совершаемых молекулами и атомами жидких и твёрдых тел, должна, как и в газах, возрастать при увеличении температуры. Этим объясняется испарение при нагревании, так как более быстро движущиеся молекулы жидкости могут преодолеть притяжение со стороны окружающих молекул той же жидкости и выскочить из жидкости наружу. Пар, насыщающий пространство над поверхностью данной жидкости, — это и есть тот газ, который состоит из таких «сбежавших из жидкости» молекул. Из жидкости выскакивают, правда, всё новые и новые молекулы, по молекулы пара, падающие на жидкость, проникают туда вновь, и поэтому в конце концов устанавливается равновесие между жидкостью и её па́ром, когда в каждую секунду столько же молекул выскакивают из жидкости («испаряется»), сколько их падает в жидкость обратно.
Из всего сказанного видно, какие простые и ясные представления вносит гипотеза атомов и молекул в физику. Основным в этой атомно-молекулярной картине газов, жидкостей и твёрдых тел является представление о том, что с возрастанием температуры растёт и скорость движения атомов. Это представление сыграло очень большую роль в истории атомистического учения.
До XIX столетия среди физиков господствовало мнение, что теплота есть какое-то невесомое вещество — «теплород», — которое может соединяться с обычными веществами. Нагретое тело, согласно этой точке зрения, — это такое, в котором много теплорода; при охлаждении тела теплород из него уходит. Это широко распространённое представление о вещественности тепла было опровергнуто, как только физики стали изучать связь между теплотой и движением. Наличие этой связи очевидно: при трении, которым сопровождается движение, возникает тепло, — этим издавна пользовались для добывания огня народы, стоящие на низких ступенях культуры, — с другой же стороны, теплота, выделяющаяся при сжигании угля в топке парового котла, является основной причиной возникающего в паровой машине движения поршня в цилиндре, махового колеса, шатуна и т. д.
8
Ряд таких «трансурановых» элементов был получен искусственно. (Прим. ред.)