И конечно, при этом возникают проблемы, которые по важности и драматизму не уступают самым острым проблемам чисто ионосферной физики.
К сожалению, однако, рассказать о всех этих проблемах в рамках небольшой книги практически невозможно. Переходя к аэрономии нейтральных частиц, мы немедленно сталкиваемся с разнообразием и просто слишком большим количеством различных реакций. Например, в области высот 50 - 100 км при рассмотрении всего цикла процессов в кислородно-азотна-водородной смеси используют обычно систему из более чем 50 фотохимических реакций.
Естественно, описать такую систему сколь-нибудь подробно здесь невозможно. А без описания трудно объяснить и суть ряда проблем. Мы ограничимся поэтому рассказом о трех самых интересных и важных на наш взгляд проблемах, связанных с нейтральными частицами. Две из них (окись азота и атомный азот), как мы увидим ниже, тесно связаны между собой и создают одну большую проблему - пожалуй, наиболее острую и злободневную в современной аэрономии.
Что касается проблемы возбужденных частиц в верхней атмосфере, то это в значительной мере все еще "terra incognita". В течение последних пяти лет лишь начали понимать, какие возможности таит в себе физикохимия возбужденных частиц для решения ряда насущных вопросов физики верхней атмосферы и особенно ионосферной физики. И конечно, за этим направлением аэрономии большое будущее.
Что же касается ряда вопросов аэрономии нейтральных частиц, не нашедших здесь отражения (диссоциация кислорода, химия водородных соединений, образование "горячих" атомов гелия и др.), автор отсылает читателей к своей книге "Химия, атмосфера и космос" или к более поздним и более серьезным публикациям, список которых приведен в конце этой книги.
Эта неприятная окись азота
Если, как мы говорили, из всех ионосферных областей больше всего хлопот и экспериментаторам, и теоретикам доставила область D, то среди нейтральных частиц первенство по "вредности", несомненно, держит окись азота.
Трудности, возникающие при изучении окиси азота в верхней атмосфере, очень похожи на трудности в постижении природы и поведения области D. Точно так же экспериментальный подход упирается в технические проблемы, а взгляды на теорию претерпевают в течение последних 10 - 15 лет непрерывные изменения, поэтому не удается построить надежных теоретических моделей.
Посмотрим подробнее, в чем же тут дело. Земная атмосфера, как известно, представляет собой смесь в основном азота и кислорода. В такой кислородно-азотной смеси азотные и кислородные частицы, взаимодействуя между собой, неизбежно должны образовывать смешанные продукты - различные окислы азота. Последние обладают большой химической активностью и поэтому вновь легко взаимодействуют с другими атмосферными составляющими- О, O2, N и т. д., что приводит к целой системе сложных фотохимических превращений. Так начинается вся эта "кухня" с окислами азота.
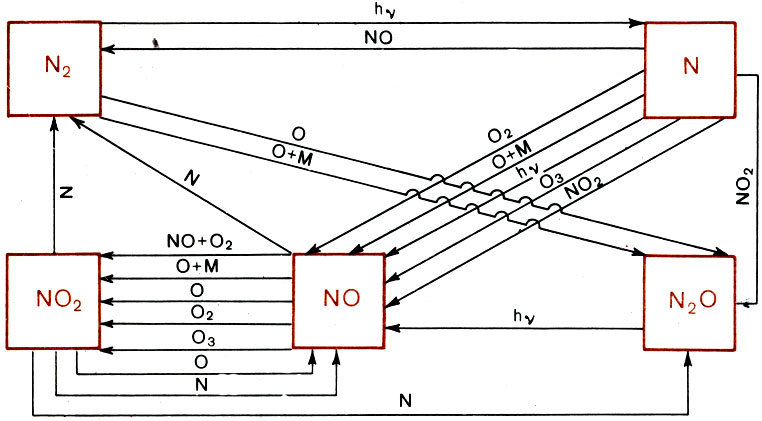
Но здесь есть одна тонкость. Молекулярный азот, составляющий большую часть атмосферного газа ниже 100 км, очень инертен. Он ленив, он не хочет вступать ни в какие соединения. Если бы азот на всех высотах в атмосфере существовал только в форме молекул, описанных в этом параграфе, проблем просто не существовало бы, так как не существовало бы практически ни N0, ни других азотных окислов. Но все дело в том, что азот, хотя и слабо, подвержен диссоциации. Молекула N2 под воздействием внешних агентов может распадаться на два атома N, хотя и гораздо менее охотно, чем молекула кислорода. И вот эти порожденные диссоциацией атомы N своей активностью с лихвой компенсируют инертность их родителя - N2. Они готовы взаимодействовать с чем угодно, и с большой эффективностью. Именно они - то и "раскачивают" достаточно инертную систему N2 + O2 и служат инициаторами и активными участниками сложной и разветвленной цепи реакции, в которой замешана интересующая нас окись азота. Действительно, посмотрите на рисунок, на котором представлена примерная схема процессов, происходящих в кислородно-азотной смеси, когда в ней появляется атомный азот. Что и говорить - запутанная картина! Трудно даже понять, что из чего получается, и что во что переходит. Ясно только, что окись азота вовлечена в эту схему очень сильно. И начинать теоретическое изучение распределения N0 надо с процесса диссоциации N2, поскольку атомы N, как мы уже знаем, заваривают всю эту кашу. Но посмотрите вновь на рисунок. Одним из путей образования N0 является реакция О2 с атомами азота
а одним (и весьма важным) из путей гибели - реакция соединения с N
Значит, N и N0 оказываются тесно связанными. Мы рассматриваем здесь только процессы с участием нейтральных частиц. А когда к делу подключатся еще и заряженные частицы, связь между окисью азота и атомным азотом становится еще более тесной и сложной. Мораль проста: невозможно всерьез обсуждать отдельно фотохимию N и N0, приходится говорить о всем цикле процессов с участием азота и его окислов. В этом-то и состоит основная трудность проблемы N0. Решение этой проблемы исторически идет по пути своего рода соревнования между измерениями количества окиси азота и усовершенствованием теории указанного цикла процессов.
Первыми рассмотрели схему реакций с участием N и N0 классики аэрономии англичанин Бейтс и бельгиец Николе. Они получили, что в области D концентрации окиси азота относительно малы и не превосходят 106 молекул на кубический сантиметр. Такой вывод был очень важен, поскольку он показывал, что N0 не может играть существенной роли в образовании области D, Это привело к проблеме дополнительного источника ионизации, описанной в предыдущей главе. Но был ли такой вывод правильным?
Поначалу казалось, что это так. Первое экспериментальное определение количества N0, сделанное японскими учеными, подтвердило выводы теории: количество окиси азота ниже 85 км не превышает 106 см-3.
Здесь следует сделать небольшое отступление - сказать о трудностях измерения N0 в верхней атмосфере. Мы знаем, что основной метод исследования состава атмосферы - масс-спектрометрический. Но окись азота, как бы много внимания ей ни уделяли ученые, является малой составляющей атмосферы. Это означает, что ее концентрации на несколько порядков меньше концентраций основных составляющих атмосферного газа - молекулярного азота и кислорода. Например, на высотах области D, о которых пока в основном ведется наш рассказ, на одну молекулу N0 приходится по меньшей мере 106 (миллион!) частиц N2 и О2. Попробуйте из миллиона частиц выловить одну молекулу N0! Масс-спектрометрам пока это еще не под силу. Да и работают масс-спектрометры ниже 100 км, как мы знаем, весьма неохотно и требуют специальных ухищрений в виде откачных устройств, охлаждения и т. д. Значит, масс-спектрометрический путь определения количества N0 не годится. Нужен метод измерения, позволяющий выделять молекулы окиси азота среди большого количества других частиц. Таким методом в принципе является оптический метод.
Каждая частица (атом или молекула) имеет свой особый спектр поглощения (или излучения), свой "оптический паспорт". Нужно только найти характерные черты этого спектра и произвести измерения в соответствующем интервале длин волн. Эти черты были найдены в виде так называемых γ-полос N0 в ближней ультрафиолетовой части спектра (1800 - 2100 Å). Если аккуратно измерить поглощение атмосферы на различных высотах в указанном интервале длин волн (скажем, с помощью фотометра, поднятого на ракете), то его можно пересчитать в концентрации N0, поскольку именно окись азота служит основным поглощающим агентом в этом интервале λ. Такова идея оптического метода. Но, как обычно, между идеей и ее воплощением стоят серьезные трудности. Они связаны в основном с двумя факторами - калибровкой фотометра и учетом фона рассеянного света, т. е. паразитного сигнала, вызванного излучением, попавшим в прибор помимо поглощающего слоя N0.