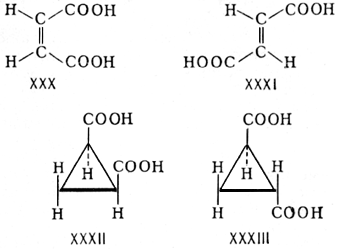
Для обозначения изомерных соединений, содержащих связи C = N или N = N, часто вместо цис и транс применяют термины соответственно син и анти . Так, в молекуле син-бензальдоксима (XXXIV) атом водорода при углероде и гидроксильная группа при азоте расположены по одну сторону плоскости, проходящей через C = N-cвязь, а в молекуле анти - бензальдоксима (XXXV) — по разные стороны этой плоскости:
Геометрические изомеры обычно существенно различаются по физическим свойствам (температурам кипения и плавления, растворимости, дипольным моментам, термодинамической устойчивости и др.). В таблице приведены некоторые свойства геометрических изомеров — малеиновой и фумаровой кислот.
Некоторые физические свойства малеиновой и фумаровой кислот
| Свойства | Малеиновая кислота (цис-форма) | Фумаровая кислота (транс-форма) |
| Температура плавления, °С | 130 | 286 |
| г | 78,8 | 0,7 |
| 1 | -2 | -4 |
| кдж/мольккал/моль | 1,35(326) | 1,34(320) |
Для непредельных соединений возможны переходы цис - формы в транс - форму и обратно; так, под воздействием небольших количеств йода, галогеноводородов или других реагентов менее устойчивая, лабильная, форма переходит в более стабильную, тогда как облучение ультрафиолетовым светом способствует обратному превращению. Геометрические изомеры различаются и некоторыми химическими свойствами. Так, малеиновая кислота, у которой карбоксильные группы пространственно сближены, легко образует малеиновый ангидрид
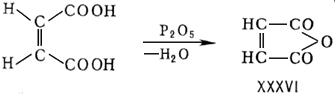
тогда как фумаровая кислота ангидрида не даёт.
Оптическая И. свойственна молекулам органических веществ, не имеющим плоскости симметрии (плоскости, разделяющей молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Такие асимметричные молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через кристалл, расплав или раствор вещества.
Оптической активностью обладают кристаллы некоторых неорганических веществ, например кварца, однако оптическая активность в этом случае обусловлена асимметрией кристаллической решётки и исчезает при переходе вещества в другие агрегатные состояния. Оптическая И. органических веществ зависит только от строения молекул и с агрегатным состоянием не связана. Голландский химик. Я. Вант-Гофф впервые предложил (1874) объяснение оптической активности на основе тетраэдрической модели атома углерода.
Чаще всего оптическая активность обусловлена наличием в молекуле асимметричного атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями. Примером может служить молочная кислота: CH3 C* H(OH)COOH (асимметрический атом углерода отмечен звёздочкой). Согласно тетраэдрической модели атома углерода, заместители располагаются в углах правильного тетраэдра, в центре которого находится атом углерода:
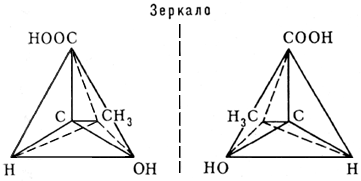
Как видно из приведённых формул, молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим зеркальным отображением. Эти две формы кислоты относятся друг к другу, как правая рука к левой, и называются оптическими антиподами (энантиомерами).
Все химические свойства оптических антиподов идентичны; одинаковы и их физические свойства, за исключением оптической активности: одна форма вращает плоскость поляризации света влево [l -или (—)-форма], другая — на тот же по величине угол вправо [d -или (+)-форма]. Ясно, что две формы одного и того же вещества с противоположными знаками вращения имеют зеркально-противоположные конфигурации . Одинаковый знак вращения разных веществ не служит доказательством сходства их конфигураций, а вещества с противоположным знаком вращения могут иметь одинаковые конфигурации, как, например, левовращающая молочная кислота и её правовращающие эфиры.
Для обозначения генетической связи веществ применяют знаки L и D , показывающие конфигурационное родство определённого оптически активного вещества с L- или D -глицериновым альдегидом или соответственно с L -или D-глюкозой. Левовращающая молочная кислота оказывается принадлежащей к D -pяду и обозначается как D- (—)-молочная кислота, правовращающая — к L -pяду и обозначается как L- (+)-moлочная кислота.
Смесь равных количеств оптических антиподов ведёт себя как индивидуальное химическое соединение, лишённое оптической активности и сильно отличающееся по физическим свойствам от каждого из антиподов. Такое вещество называется рацемическим соединением, или рацематом [d, l- или (±)-форма]. При всех химических превращениях, при которых образуются новые асимметричные атомы углерода, всегда получаются рацематы, так как вероятности образования правовращающей и левовращающей форм равны.
В случае соединений типа abcC’ — C’’def, содержащих два асимметричных центра, возможны следующие четыре изомера соответственно конфигурации асимметричных атомов C’ и С’’: левый — левый (I), левый — правый (II), правый — правый (III) и правый — левый (IV):
| I | II | III | IV |
| —A | —A | +A | +A |
| —B | +B | +B | —B |
(А и В обозначают соответственно атомы C’ и С’’).
Формы I и III, II и IV — оптические антиподы. Формы I и II, I и IV, II и III не являются антиподами, так как конфигурации одного асимметричного центра у них противоположны, а другого совпадают. Такие оптические изомеры называются диастереоизомерами, или диастереомерами . Диастереомеры резко различаются по всем важнейшим физическим свойствам. Если же заместители при двух асимметричных центрах одинаковы, т. е. в случае соединений типа abc — C’ — С’’ — abc [например, винные кислоты НООСС* Н(ОН)C* H(ОН)СООН], формы II и IV совпадут и дадут оптически недеятельную форму (мезо -форму), так как оптическая активность одного центра (C’) компенсируется равной по величине и противоположной по знаку активностью другого центра (С’’).
Рацемические соединения могут быть расщеплены на оптические антиподы. Для этого обычно используют реакции с оптически активными веществами.
Оптическая И. играет важнейшую роль в биологических процессах. Оптически активными являются природные аминокислоты, углеводы, алкалоиды и др.
Оптическая И. циклических соединений тесно связана с геометрической И.; так, транс - форма дизамещённого циклического соединения (например, XXXIII) не совпадает со своим зеркальным отображением.
Химическими методами можно определить относительную конфигурацию вещества, т. е. принадлежность его к D- или L -ряду. Вопрос же об абсолютной конфигурации, т. е. о действительном расположении заместителей в пространстве вокруг асимметричного центра, решается физическими методами — на основании данных дисперсии оптического вращения и рентгеноструктурного анализа. Оптическая И. может быть обусловлена не только наличием асимметричных атомов, но и асимметрией молекулы в целом, как, например, у замещенных алленов и спиранов: