Изомеразы
Изомера'зы, класс ферментов, катализирующих внутримолекулярные перемещения различных групп, в том числе и реакции взаимного превращения различных изомеров. И., катализирующие взаимопревращения стереоизомеров, называются рацемазами или эпимеразами в зависимости от числа центров асимметрии в молекуле субстрата (см. Изомерия ). К И. относятся также цис-транс - изомеразы, внутримолекулярные оксидоредуктазы , внутримолекулярные трансферазы , внутримолекулярные лиазы . Иногда ферменты, катализирующие перенос каких-либо групп от одного участка молекулы к другому, называются мутазами.
Изомеризация
Изомериза'ция, превращение какого-либо химического соединения в его изомер . При И. могут изменяться углеродный скелет молекулы, характер функциональных групп и их положение, может происходить сужение или расширение цикла и т. д. Так, насыщенные углеводороды нормального строения при действии хлористого алюминия (AlCl3 ) превращаются в углеводороды изостроения (например, бутан — в изобутан):
СН3 СН2 СН2 СН3 ® (CH3 )2 CH — CH3
Эти превращения происходят при переработке нефти (процессы — крекинг, пиролиз, риформинг) и приводят, в частности, к получению бензинов с высоким октановым числом . Циклогексаноноксим под действием кислот изомеризуется в капролактам — исходный продукт для получения синтетического волокна капрон (см. Полиамидные волокна ):
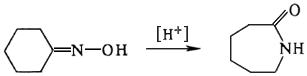
Эта И. — частный случай бекмановской перегруппировки. Среди других практически важных процессов И. — превращение окиси этилена в ацетальдегид, изомеризация о- и м -ксилолов в n -кcилол, окислением которого получают терефталевую кислоту , превращение гидразобензола в бензидин и др. Понятие изомеризации включает также взаимные превращения геометрических изомеров, например малеиновой (I) и фумаровой (II) кислот:
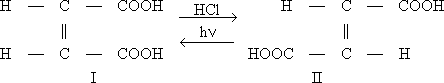
и многочисленные случаи рацемизации оптически деятельных веществ (см. Стереохимия ).
Б. Л. Дяткин.
Изомерия
Изомери'я (от изо... и греч. méros — доля, часть) химических соединений, явление, заключающееся в существовании веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
И. открыта в 1823 Ю. Либихом , показавшим, что серебряная соль гремучей кислоты Ag — О — N = C и изоцианат серебра Ag — N = C = O имеют один и тот же состав, но совершенно разные свойства. Термин «И.» предложен в 1830 И. Берцелиусом . Особенно распространена И. среди органических соединений. Явление изомерии было успешно объяснено теорией химического строения, разработанной в 60-х гг. 19 в. А. М. Бутлеровым .
Различают два основных вида И.: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Структурная И. подразделяется на несколько разновидностей. И. скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Так, может существовать только один нециклический насыщенный углеводород с тремя атомами С — пропан (I). Углеводородов такого же типа с четырьмя атомами С может быть уже два: н -бутан (II) и изобутан (III), а с пятью атомами С — три: н -пентан (IV), изопентан (V) и неопентан (VI):
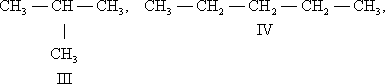
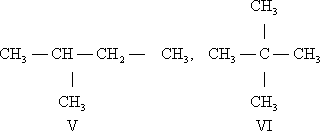
Для углеводорода C20 H42 возможно уже 366 319 изомеров.
И. положения обусловлена различным положением какой-либо реакционноспособной группы (функциональной группы, заместителя) при одинаковом углеродном скелете молекул. Так, пропану соответствуют два изомерных спирта: н -пропиловый (VII) и изопропиловый (VIII):
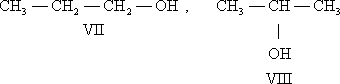
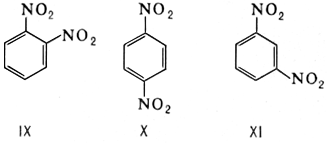
Важную роль играет И. положения у соединений ароматического ряда, так как положение заместителей в бензольном ядре — один из главных факторов, определяющих реакционную способность вещества. Например, о -динитробензол (IX) и n -динитробензол (X) легко реагируют с аммиаком, тогда как м -динитробензол (XI) в реакцию с NH3 не вступает.
В ряду алифатических простых эфиров, сульфидов и аминов существует специальный вид И. — метамерия, обусловленная различным положением гетероатома в углеродной цепи. Метамерами являются, например, метилпропиловый (XII) и диэтиловый (XIII) эфиры:
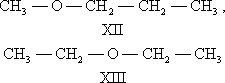
Термин «метамерия» применяется всё реже.
И. непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 (XIV) и бутене-2 (XV), в винилуксусной (XVI) и кротоновой (XVII) кислотах:
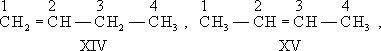
В большинстве случаев структурные изомеры сочетают признаки И. скелета и И. положения, содержат различные функциональные группы и принадлежат к разным классам веществ, вследствие чего они отличаются друг от друга значительно больше, чем рассмотренные выше изомеры веществ одного и того же типа. Например, изомерами являются пропилен (XVIII) и циклопропан (XIX), окись этилена (XX) и ацетальдегид (XXI), ацетон (XXII) и пропионовый альдегид (XXIII), диметиловый эфир (XXIV) и этиловый спирт (XXV), аллен (XXVI) и метилацетилен (XXVII):
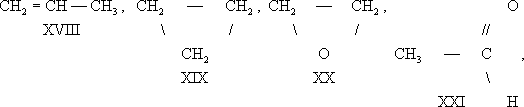
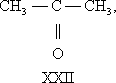
Особым видом структурной И. является таутомерия (равновесная динамическая И.) — существование вещества в двух или более изомерных формах, легко переходящих друг в друга. Так, ацетоуксусный эфир существует в виде равновесной смеси кетонной (XXVIII) и енольной (XXIX) форм:
Пространственная И. подразделяется на два вида: геометрическую И. (или цис-транс -И.) и оптическую И. Геометрическая И. свойственна соединениям, содержащим двойные связи (С = С, C = N и др.), и неароматическим циклическим соединениям; она обусловлена невозможностью свободного вращения атомов вокруг двойной связи или в цикле. В этих случаях заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис - положение), либо по разные стороны (транс - положение). Понятия «цис» и «транс» обычно относят к паре одинаковых заместителей, а если все заместители разные, то условно к одной из пар. Примерами геометрических изомеров могут служить две формы этилен-1,2-дикарбоновой кислоты — цис -форма, или малеиновая кислота (XXX), и транс - форма, или фумаровая кислота (XXXI), а также цис - и транс - формы циклопропан-1,2-дикарбоновой кислоты (соответственно XXXII и XXXIII):