* Речь идет об известной работе А. М. Бутлерова до синтезу и изучению свойств диизобутилена26.
109
«более отвечают нашим настоящим фактическим данным»:
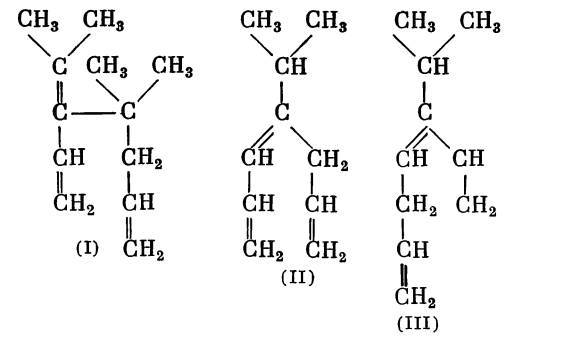
«Мы приготовили, — продолжает письмо А. М. Зайцев, — диаллилизопропилкарбинол с целью получить из него углеводород с 1-й формулой строения (II) и сравнить его с известными терпенами».
А. М. Зайцев, соглашаясь с такими видными исследователями терпенов, как Тильден и Флавицкий, что в терпенах нет циклической связи, показывал, как, например, из соединения (III) путем последовательной гидратации и дегидратации может образоваться замкнутая группировка, например
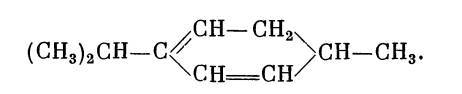
Однако исследования углеводородов, получаемых из непредельных спиртов, не привели к определенным результатам возможно потому, что, как деликатно пишет
С. Н. Реформатский, «другие работы помешали их осуществлению» 29. Пожалуй, единственным положительным результатом этих исследований надо считать доказательство строения диаллила (В. Сорокин, 1879), для которого допускалась ранее и неверная формула СНз—СН = СН-СН = СН-СН3.
В лаборатории А. М. Зайцева были проведены многочисленные исследования по получению из непредельных спиртов и углеводородов многоатомных спиртов. Первый способ — присоединение к непредельным углеводородам брома с последующим переводом бромидов
110
в уксусные эфиры, а затем замещение ацетильной группы на гидроксильную. Этот способ применялся для установления строения норм, бутилена и затем амилена из ди- этилкарбинола.
Второй способ заключался в присоединении хлорноватистой кислоты к непредельным углеводородам с последующим действием щелочи на хлорангидриды (реакция Кариуса). Правда, этот метод применялся ранее А. П. Эльтековым в Харькове. При получении по этому поводу многоатомных спиртов обнаружилось, что одновременно образуются и окиси. А. М. Зайцев писал А. М. Бутлерову (7 января 1885 г.): «Наши лабораторные занятия подвигаются довольно успешно. В хлорноватистой кислоте мы нашли довольно удобный реагент для перехода от наших непредельных спиртов и от некоторых непредельных углеводородов к многоатомным спиртам. До настоящего времени мы приготовили такие спирты из аллилдиметилкарбинола, диаллилкарбинола и диаллила, но пока подвергался анализу лишь последний спирт. При анализе мы получили результат, говорящий за то, что здесь получается 1-я окись соответствующего 4-х атомного спирта. Результат этот сходен с прежним наблюдением брата (М. М. Зайцева. — Г, Б.) —относительно 5-ти атомного спирта из диаллилкарбинола. Не находятся ли эти соединения, по своему строению, в родстве с глюкозами?»30. И далее в письме от 20 февраля того же года А. М. Зайцев писал: «В прошлом письме я сообщил Вам, что мы получили действием СЮН на [диаллил] диаллилхлоргидрин CH2CI—СНОН—СН2—СН2— СНОН—CH2CI, затем двуокись
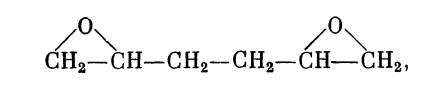
которая дала при нагревании с гюдой не самый 4-х-атом- ный спирт, а его первую окись, т. е. спирто-окись... Реформатский почти закончил это исследование» 31. Результаты этого и других исследований в том же направлении составили содержание магистерской диссертации С. Н. Реформатского «Предельные многоатомные алкоголи» (Казань, 1889 г.) *.
* Еще в том же 1885 году между московской лабораторией и казанской, а вернее, между их руководителями В. В. Марков-
111
Третий способ получения многоатомных спиртов стал применяться в лаборатории А. М. Зайцева с 1892 г., после того как Е. Е. Вагнером было обстоятельно изучено окисление непредельных соединений марганцовокалиевой солью (см. след, главу).
Выше мы упоминали о получении оксикислот при действии цинка на смеси йодистого аллила с эфирами щавелевой кислоты. Большое число оксикислот было получено в лаборатории А. М. Зайцева также при окислении непредельных спиртов марганцовокалиевой солью. Согласно А. М. Зайцеву [29], при окислении непредельных спиртов группа СН2= в радикале аллиле отщепляется, окисляясь в муравьиную и угольную кислоты, а группа —СН = превращается в карбоксильную. Обычным путем из этих оксикислот получали иодкарбоновые кислоты, а из них — одноатомные предельные кислоты. Эти работы выполнялись в лаборатории А. М. Зайцева студентами-практикантами.
От цинкорганического синтеза к магнийорганическому
В 1900 г. появилась первая работа В. Гриньяра, положившая начало широчайшему применению магнийор- ганического синтеза в органической химии. Как писал
С. Н. Реформатский, «Барбье и Гриньяр внесли незначительное по существу и очень важное по последствиям видоизменение в синтез А. М. Зайцева: они заменили цинковые соединения магниевыми и повели реакцию в присутствии растворителя; это обстоятельство сильно (в 2—3 раза) повысило выходы спиртов и позволило расширить случаи применения галоидных магнийорганиче- ских соединений. Наступило всеобщее увлечение видоизмененным способом Гриньяра, и химики стали забывать имя А. М. Зайцева, называя этот способ синтезом Гриньяра. Такое отношение к А. М. Зайцеву было, конечно, несправедливо и очень огорчило А. М. Действительно, дана и разъяснена эта реакция А. М. Зайцевым, à по-
никовым и А. М. Зайцевым завязалась полемика по поводу работ С. Н. Реформатского, по поводу его права продолжать исследования в том же направлении, так как аналогичные исследования начаты были также П. П. Орловым и продвинулись даже дальше в лаборатории В. В. Марковникова32.
112
тому, если и нужно упоминать имя Гриньяра, то после имени Зайцева, а еще правильнее называть этот синтез синтезом Зайцева—Барбье—Гриньяра; второе имя принадлежит учителю Гриньяра, под руководством которого последний работал» 33.
Известно, кроме того, что в Казанской лаборатории студентом А. Е. Арбузовым в 1900 г. проведена была работа по синтезу третичного спирта с применением магния и обезвоженного эфира. Так как в литературе по этому поводу можно встретить не совсем точные высказывания, целесообразно этот момент в истории химии рассмотреть достаточно подробно.
На заседании Отделения химии Русского физико-химического общества Б. Н. Меншуткин 2 ноября 1900 г. доложил пять работ из лаборатории Казанского университета, в том числе и работу А. Е. Арбузова «Об аллил- метилфенилкарбиноле ». Протокольная заметка гласит : «Этот ароматический третичный спирт сначала готовится по обычному способу, т. е. действием ацетофенона и йодистого аллила на цинк. Для получения хороших (до 31,5% теории) выходов спирта оказалось, однако, необходимым вести реакцию в среде безводного эфира, иначе реакция идет слишком сильно и образуются лишь смолообразные продукты. Вместо цинка можно взять и магний». Далее описание свойств полученного продукта34.
Полностью сообщение А. Е. Арбузова, датированное 29 октября 1900 г., было опубликовано в 1-м выпуске «Журнала Русского физико-химического общества» за 1901 г. А. Е. Арбузов провел несколько опытов. В первом смесь ацетофенона и йодистого аллила приливалась по каплям «на мелкозерненный цинк с небольшим количеством цинк-натрия», во втором опыте вместо цинка был взят магний в порошке, но реакция протекала бурно, и произошло обугливание. «После этого неудачного опыта условия реакции были изменены, именно реакция велась в среде безводного эфира», но кроме порошка магния в реторту были всыпаны и «разъеденные» цинковые стружки. Этот, третий опыт, так же как и четвертый, отличавшийся лишь количеством взятого магния, оказался успешным. Но и пятый опыт, в котором вовсе не было взято магния, а были одни цинковые стружки, также привел к синтезу аллилметилфенилкарбинола. «Таким образом, — писал А. Е. Арбузов, — оказалось,
8 А. G. Ключевич, Г. В. Быков 113
что при получении аллилметилфенилкарбинола магний не играл никакой роли, а следовательно, в реакцию можно с успехом брать одни цинковые стружки. Очевидно, что улучшению выхода спирта способствовал один только эфир, который умерял реакцию и таким образом предотвращал образование смолистых продуктов»35.