105
ным углеродный атом, связанный с группой ОН, между тем как распадение происходит за счет окисления углеродных паев с двойной связью» [29, с. 23]. Следствием такого механизма окисления непредельных спиртов является и появление среди продуктов окисления муравьиной и угольной кислот как результат дальнейшего окисления, например, той же оксивалерьяновой кислоты.
В письме к А. М. Бутлерову от 7 января 1885 г. А. М. Зайцев сообщал: «.. .нам, кажется, удалось найти новый синтез третичных предельных спиртов, а именно — при действии C2H5J и Zn на бутирон (С3Н7СОС3Н7. — Г. Б.). Мы получили
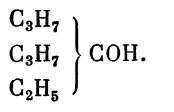
Эта реакция, по-видимому, происходит лишь с кетонами, не содержащими радикал метил»22. О том, что такой путь к синтезу предельных третичных спиртов оказался перспективным, А. М. Зайцев сообщил в феврале того же года [42]. В этой короткой заметке, имевшей задачей сохранить за своей лабораторией право на работу в данном направлении, А. М. Зайцев ссылается на многочисленные примеры (Бейлыптейн и Рит, А. М. Бутлеров, Д. П. Павлов в лаборатории А. М. Бутлерова) неудачных попыток взаимодействия полных цинкдиалкилов с кетонами, однако, как пишет А. М. Зайцев, капитальное исследование Е. Е. Вагнера, касающееся синтеза вторичных спиртов из альдегидов, давало надежду добиться успеха и с кетонами при соответствующем подборе условий. А. М. Зайцев подметил, что во всех исследованных кетонах карбонильная группа связана с метальной группой. Отсюда появилась мысль провести реакцию с кетонами иного строения. Об успехе этой попытки он сообщает в письме к А. М. Бутлерову, а в упомянутом предварительном сообщении, датированном 20 февраля 1885 г., пишет: «До настоящего времени я, совместно со студентами А. Чеботаревым и князем
С. Баратаевым, исследовал содержание к йодистому
Новый синтез предельных спиртов
с3н71 с3н7 1сон. С2нб J
I
106
этилу и цинку дипропилкетона (бутирона) и диэтилке- тона. В обоих случаях мы получили металлоорганическое соединение кетона с цинкэтилом, которое, по разложении водою, дало соответствующие спирты: этилдипропил- карбинол и триэтилкарбинол» [42, с. 179]. В том же году А. Зайцевым, кроме названных работ [45, 47], были еще опубликованы сообщения о синтезе таким методом метилдипропилкарбинола со студентом А. Горталовым [46] и дипропилкарбинола со студентом Д. Устиновым [48]. В последнем случае взятый в качестве реагента про- пилиодид распадался на пропилен и иодоводород, который и восстанавливал бутирон до дипропилкарбинола.
Синтезы непредельных третичных спиртов заставили А. М. Зайцева изменить его взгляд на механизм реакций с участием йодистого аллила, но при этом еще не побудили оставить. прежнюю схему реакций для синтеза предельных третичных спиртов с участием алкилиодидов. Однако синтезы третичных спиртов исходя из кетонов привели к определенному заключению о том, что исследованные реакции идут за счет смешанных цинкоргани- ческих соединений. Решающим доводом были отрицательные результаты опытов по взаимодействию диэтилцинка с различными по строению кетонами, в то время как взаимодействие иодцинкэтила с бутироном привело к синтезу этилдипропилкарбинола. Такая работа и была проведена в лаборатории А. М. Зайцева23. Из нее следовало, что образование цинкдиэтила за счет взаимодействия этилиодида с цинком до реакции с кетонами не происходит. Тем самым А. М. Зайцев внес коррективы в тот механизм, который А. М. Бутлеров принимал для реакции образования третичных спиртов.
В лаборатории А. М. Зайцева были проведены опыты с действием йодистого аллила и цинка на эпихлоргидрин (М. Лопаткин, 1883 и 1884), но они, по-видимому, не привели к обнадеживающему результату.
Уже было упомянуто о том, что первые опыты с цинк- органическими соединениями в лаборатории А. М. Зайцева были поставлены его братом Михаилом (1868), объектом изучения которого была реакция смеси уксусного ангидрида с йодистым этилом или метилом с цинк- натрием. Много лет спустя, уже в 1904 г., в год смерти М. М. Зайцева24, А. М. Зайцев следующим образом сформулировал задачу исследований с ангидридами кис¬
107
лот: «Исходя из предположения, что при реакции иод- цинкаллила на ангидриды кислот будут образовываться непредельные третичные спирты с двумя радикалами аллила с лучшим выходом, чем при действии того же реагента на эфиры кислот, мы исследовали отношение к иодцинкаллилу уксусного ангидрида. Так как сделанное предположение фактически оправдалось, то мы и имеем в виду распространить, в ближайшем будущем, эту реакцию на ангидриды одноосновных и двухосновных кислот вообще, а также исследовать отношение названных ангидридов к различным галоидорганическим соединениям в присутствии цинка» [61, с. 16].
И последняя работа А. М. Зайцева (1907 г.) посвящена именно этой теме [62]. Взаимодействие йодистого аллила и цинка с уксусным ангидридом, проведенное уже в эфирной среде, привело к получению диаллилме- тилкарбинола с лучшим выходом, чем раньше при реакции с уксусно^тиловым эфиром.
Продукты превращения спиртов.
Оксикислоты
Полученные А. М. Зайцевым и его учениками предельные и непредельные спирты были исследованы по их физическим и химическим свойствам. Из физических свойств изучались температуры кипения (как самим А. М. Зайцевым [29], так и Ф. М. Флавицким) и рефракции. При этом были выявлены некоторые расхождения с правилами Брюля. Затем из этих работ выросло самостоятельное направление И. И. Канонникова (1881 г. и сл.) 25.
Из химических свойств спиртов, изучение которых позволяло с большой убедительностью судить об их строении, изучалась их способность давать эфиры, галогенопроизводные, а из последних углеводороды. Основным же методом для установления строения спиртов было деструктивное окисление.
Выше уже было упомянуто о том, что при изучении диэтилкарбинола был получен соответствующий ему иодид, из него углеводород, а последний в свою очередь превращен, во-первых, в иодид и спирт, и, во-вторых, в дибромид и гликоль, который и был подвергнут окислению. Подобным же образом были исследованы и дру¬
108
гие спирты, синтезированные в лаборатории А. М. Зайцева, причем наибольшее число продуктов превращения давали непредельные спирты.
Превращение непредельных спиртов путем отщепления воды в непредельные углеводороды ряда СЛН2я_2 особенно интересовало А. М. Зайцева, потому что он надеялся получить таким образом углеводороды, родственные терпенам [84]. В письме А. М. Бутлерову от 30 сентября 1878 г. А. М. Зайцев писал: «Спешу поделиться с Вами некоторыми химическими новостями, которые близко соприкасаются с Вашими прошлогодними исследованиями *. Действием воды с несколькими каплями H2SO4 нам удалось превратить аллилдиметилкарбинол в углеводород СбНю и его полимер G12H20, т. е. произвести реакцию, аналогичную Вашей реакции с триметил- карбинолом... Аллилдипропилкарбинол, хотя и реагирует аналогично, одпако значительно труднее, и здесь образуется главным образом углеводород CioHie. Даже при нагревании до 160° образуются только следы полимера. Мы исследуем теперь содержание углеводорода С12Н20 с окисляющим веществом. Результат этой реакции весьма нас интересует еще и потому, что я полагаю, что углеводород этот есть близкий родственник терпенам» 27. Однако у А. М. Зайцева не было правильного представления о строении терпенов, которое было установлено в основных чертах спустя 20 лет главным образом благодаря работам Е. Е. Вагнера28. А. М. Зайцев писал далее: «Принимая во внимание, что терпены дают при окислении и при других превращениях жирные и ароматические соединения, я думаю, что терпены при свойственной жирным телам простой связи углеродных атомов обладают таким расположением некоторых атомов углерода, при которых возможно образование из них чистой реакцией замкнутой (бензольной) группировки». По аналогии с формулой только что полученного и изученного А. М. Бутлеровым диизобутилена А. М. Зайцев предположительно принимает для своего углеводорода С12Н20 формулу (I), а для терпенов — аналогичные формулы (II) — (III), которые, как он пишет А. М. Бутлерову,