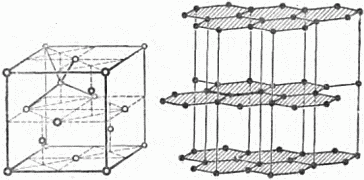
Рис. 28. Слева – решётка алмаза, справа – графита.
Эта особенность давать разные кристаллы принадлежит не только одному углероду. Почти каждый химический элемент, и не только элемент, но и любое химическое вещество, существуют в нескольких разновидностях. Нам известно шесть разновидностей льда, девять разновидностей серы, четыре разновидности железа…
Графит и алмаз устойчивы. Они могут неопределённо долго сохраняться в обычных земных условиях. Так обстоит далеко не со всеми разновидностями одного вещества.
Есть два вида олова: белое и серое. При температуре выше +18° атомы олова располагаются в одной решётке; эта разновидность называется белым оловом; при более низкой температуре атомы начинают менять взаимное расположение: белое олово превращается в серое, которое получается при этом в виде порошка. Новые кристаллики растут из старого кристалла так же, как из жидкости (см. стр. 53).

Рис. 29. Слева – элементарная ячейка гамма-железа, справа – альфа-железа.
Ниже мы узнаем, насколько большое значение имеет для техники существование разновидностей у железа: при высокой температуре атомы железа образуют гранецентрированную решётку (гамма-железо, слева на рисунке 29), при нормальной температуре – объёмно-центрированную решётку (альфа-железо, справа там же).
11. Почему слюда слоистая
До сих пор мы обсуждали вопросы строения кристаллов. Теперь поговорим об их свойствах.
Наиболее замечательная особенность свойств кристалла – это анизотропия. Смысл этого слова, имеющего греческое происхождение, следующий: изотропный – одинаковый по всем направлениям, анизотропный – разный в разных направлениях.
Возьмите кусок стекла (стекло – не кристаллическое тело; см. стр. 61) и попробуйте его сломать, сжимая прессом в каком-либо направлении. Установите величину давления, разрушающего стекло, а затем проделайте над другим таким же куском стекла новое измерение, установив теперь образец под прессом по-иному. Вторая цифра практически совпадает с первой. Хрупкость стекла не зависит от направления, в котором происходит сдавливание. (Конечно, при подобном опыте образцы должны быть одинаковой формы – например, кубики, вырезанные в разных положениях из одного и того же большого литого куска.)
Известно, что тела при нагревании расширяются. Нагреем шар из стекла. Тщательно измерим образец после нагревания. Он сохранил свою шаровидную форму. Во всех направлениях кусок стекла расширился одинаково.
Какие бы свойства куска стекла мы ни изучали, всегда окажется, что во всех направлениях стекло обладает одинаковыми свойствами. Стекло – изотропный материал.
Примеры анизотропных материалов также встречались каждому. Кто не знает, что совсем разные силы надо прилагать, раскалывая полено дров вдоль или поперёк. И другие свойства дерева зависят от направления. Дерево – анизотропный материал.
Причины анизотропии дерева видны невооружённым глазом. Дерево имеет волокнистое строение, волокна вытянуты вдоль его ствола. Разрубить полено вдоль волокон легче, так как требуется лишь отделить одни волокна от других. Разрубить полено поперёк волокон трудно, так как надо перерубить множество волокон.
Так же, как и анизотропия дерева, анизотропия кристаллов объясняется их строением. Анизотропия кристаллов очень отчётливо выражается в их спайности – так называется способность кристаллов раскалываться по определённым плоскостям. Не все кристаллы обладают одинаково хорошей спайностью. Легче всего наблюдать это свойство на каменной соли, кальците, слюде.
Кристаллы каменной соли раскалываются на маленькие кубы и прямоугольные параллелепипеды, кристаллы кальцита – на маленькие ромбоэдры; слюда при самом малом усилии расщепляется на листочки. В перечисленных и других подобных случаях бросается в глаза основная внешняя особенность кристалла – быть огранённым плоскостями.
При разрушении кристаллов менее совершенной спайности может показаться, что образцы разрушаются бесформенно. Однако наблюдение под микроскопом покажет, что это не так. Менее совершенная спайность препятствует разделению кристалла большими плоскостями, но всё равно поверхность осколков имеет «ступенчатый» характер – только величина этих плоских ступенек меньше.
Спайность кристалла показывает как нельзя лучше, что прочность кристалла резко различна в разных направлениях. Следует полагать, что силы сцепления между атомами, из которых построен кристалл, очень слабы в направлении, перпендикулярном плоскостям спайности.
Лучше всего это иллюстрируется примером графита. Расстояние между центрами ближайших атомов внутри слоев, из которых построен кристалл графита (см. выше рис. 28), в 21/2 раза меньше расстояния между слоями. Немудрено, что кристаллы графита встречаются чаще всего в виде тонких чешуек. Наличие столь ярко выраженной плоскости спайности позволяет твёрдому графиту служить смазочным материалом в тех случаях, когда невозможно применение смазочных масел, – например, если скорость движения трущихся частей очень мала, а также при высокой температуре. Графит – твёрдый смазочный материал!
Трение между двумя телами сводится, грубо говоря, к тому, что микроскопические выступы одного тела западают в неровности другого. Усилие, достаточное для того, чтобы расщепить микроскопический графитовый кристаллик, много меньше сил трения, поэтому наличие графитовой смазки значительно облегчает скольжение одного тела по другому.
Мы не приводим схемы строения кристалла слюды – это довольно сложное химическое соединение. Но причина совершенной спайности слюды та же, что и у графита – расположение атомов слоями.
Однако кристалл с совершенной спайностью может и не иметь подобной слоистой структуры.
На рисунке 30, а показана ещё раз упаковка ионов в кристалле каменной (поваренной) соли. Изображён один элементарный куб; его грани состоят из чередующихся ионов хлора и натрия.
Попытаемся разобраться, какие плоскости выделяются здесь среди других, по каким плоскостям легче всего разломать кристалл.
Снимем один вершинный шар – обнажилась плоскость, перпендикулярная телесной диагонали. Эта плоскость состоит из одних ионов натрия (рис. 30, б). Удалим тройку натриевых ионов – следующая параллельная атомная плоскость состоит из одних ионов хлора (рис. 30, в), и так далее.



Рис. 30.
Все эти слои попеременно заряжены с разным знаком: слой хлора – отрицательно, слой натрия – положительно. Поэтому они очень сильно притягиваются друг к другу, и раскалываться по таким плоскостям кристалл не будет.
Напротив, раскалывание легко происходит параллельно грани куба. Как нетрудно сообразить, каждый из разделяемых при этом слоев содержит поровну и положительных и отрицательных ионов. Притяжение между такими в целом не заряженными слоями мало. По этим-то направлениям и проходят в кристалле каменной соли плоскости спайности.
Различие по разным направлениям хрупкости кристаллов, выражающееся в явлении спайности, бросается в глаза.
Анизотропию других свойств кристалла наблюдать несколько труднее.