Итак, элементарная ячейка трёхслойной шаровой упаковки – это куб, у которого в вершинах и серединах граней расположены центры атомов. Такую ячейку, называемую кубической гранецентрированной, имеет ряд металлов, например: алюминий, медь, никель, при высокой температуре – железо (о влиянии температуры мы скажем ниже, на страницах 38 и 63).
Мы видим теперь, что реальный кристалл представляет собой систему плотно упакованных частиц, расположение которых повторяется в пространстве. Узлы и линии, соединяющие узлы, – лишь мысленная схема, помогающая нам выделить в кристалле элементарный кирпич и наметить направления, в которых его нужно перекладывать, чтобы заполнить весь кристалл.
Несколько слов о размерах «шаров»-атомов. Точные измерения, произведённые при помощи рентгеновских лучей, привели к следующим данным: радиусы атомов разных веществ колеблются в небольших пределах, примерно от 0,5 до 2 стомиллионных долей сантиметра.
Мы рассматривали упаковки, составленные из одинаковых шаров. Это значит, что пока речь шла о кристаллах химических элементов, содержащих атомы только одного сорта (правда, и элементы не все построены так просто). Перейдём теперь к кристаллам, построенным из атомов нескольких сортов, то есть к кристаллам сложных веществ.
8. Упаковка атомов
Опыты показывают, что кристаллы очень многих сложных веществ мы можем также изобразить, как плотные упаковки шаров. Атомам разных сортов соответствуют шары различных размеров. Строительным материалом кристаллов служат при этом, главным образом, электрически заряженные атомы – ионы[5].
Представим себе, что надо упаковать равное количество крупных и малых шаров. Как сделать упаковку наиболее плотной?
Учёные нашли ответ на этот вопрос. Рассматривая упаковки шаров одинакового размера, мы видим, что не всё пространство заполнено шарами. В упаковках сохраняются пустоты; можно подсчитать, что их объём составляет около 1/4 общего объёма. Пустоты эти – двух разных сортов: одни из них окружены 4 шарами, центры которых размещены в вершинах правильного четырёхгранника – тетраэдра (см. главу 1); другие окружены 6 шарами, причём центры этих шаров образуют правильный восьмигранник – октаэдр. Первые меньше по своим размерам, и их число вдвое больше, чем вторых.
Теперь нам понятно, как упаковать шары двух разных размеров: надо составить плотнейшую упаковку из более крупных шаров и в пустотах разместить меньшие (не обязательно во всех пустотах!).
На рисунке 23 слева наверху показано, как располагается маленький шар в меньшей (окружённой 4 шарами) пустоте. Для наглядности окружающие пустоту крупные шары представлены не целиком, а секторами, вырезанными из них подобно тому, как вырезают клинья из арбузов.
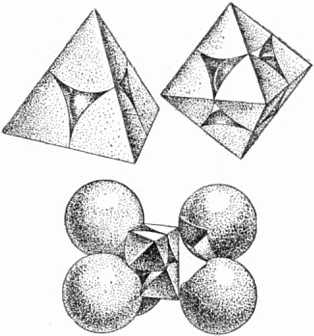
Рис. 23. Вверху: слева – малая, справа – большая пустоты в плотной упаковке шаров; внизу указано, как вырезана правая фигура.
Наверху справа маленький шар расположен в большей пустоте (окружённой 6 крупными шарами), а внизу показан способ вырезания секторов из шести соседних шаров (передний шар при этом убран).
Пустоты обоих сортов можно найти на рисунке 22 (гранецентрированный куб). Например, большая пустота находится в центре куба; центры окружающих её шести атомов – это три крестика и три квадрата на серединах граней.
Можно подсчитать, что в любой плотной упаковке одинаковых шаров на каждый шар приходится одна большая и две меньшие пустоты. Маленькие шары размещаются в этих пустотах; если же они несколько велики для пустот и не помещаются там, то раздвигают соседние крупные шары, разрыхляя плотную упаковку.
То обстоятельство, что упаковки могут быть построены из разного числа слоев и «узор» заполнения пустот маленькими шарами может быть также различен, ведёт к величайшему многообразию структур кристаллов.
Кристаллы поваренной соли представляют собой плотную трёхслойную упаковку крупных ионов хлора (светлые шары на рисунке 24,а); ионы натрия (тёмные шары) заполняют все большие пустоты, поэтому каждый ион натрия окружён шестью ионами хлора.
Сернистое железо (пирротин) представляет собой двухслойную упаковку крупных ионов серы; меньшие ионы железа заполняют все крупные пустоты. В кристалле окиси лития, где по химическому составу на один атом кислорода приходится два атома лития, плотную упаковку образуют крупные ионы кислорода; маленькие ионы лития заполняют все меньшие пустоты. Поэтому каждый ион лития имеет четырёх соседей – ионы кислорода.
В кристалле хлористого кадмия (химический состав его – два атома хлора на один атом кадмия) плотная упаковка образована крупными ионами хлора (крупные шары на рисунке 24,б). Ионы кадмия, изображённые маленькими шарами, заполняют большие пустоты, но не все, а через два слоя ионов хлора. На рисунке 24, б для ясности посредине удалено два слоя крупных шаров, не содержащих между собой малых шаров. Линиями показана элементарная ячейка кристалла.

Рис. 24. Упаковки ионов в кристаллах: а – поваренной соли; б – хлористого кадмия.
Мы привели лишь простейшие «узоры» заполнения пустот плотной упаковки.
Большие работы по описанию кристаллических структур приведённым способом сделаны членом-корреспондентом Академии наук СССР Н.В. Беловым. Эти работы принесли значительную пользу науке, позволили найти много закономерностей, объясняющих механические, оптические и электрические свойства различных минералов.
Напомним, что представление об атомах, как о шарах, правильно отражая одно важное свойство атомов – свойство укладываться в плотные кристаллические упаковки, вовсе не исчерпывает сложнейшей природы атомов и не означает, что атомы – просто твёрдые шарики.
Уподобление атома шарику означает, по существу, следующее. Вокруг ядра атома, как вокруг центра, мы мысленно проводим сферу такого радиуса, что основная часть электронов данного атома попадает внутрь этой сферы. Вот и получается шар, который служит, как говорят, моделью атома.
Воспроизведённая нами картина строения кристалла была бы неполной, если бы мы не сказали ещё о некоторых особенностях поведения атомов в кристалле.
Дело в том, что при объединении атомов в кристалл, некоторая доля их электронов «обобществляется» – начинает принадлежать не отдельным атомам, а всему кристаллу в целом. Постоянное движение около одного атома для этих, так называемых свободных электронов прекращается, и они «бродят» по всему объёму кристалла, пристраиваясь временно к встречным ионам и вновь покидая их. При этом остовы атомов – их ядра с основной массой электронов, то есть ионы кристаллической решётки, совершают лишь малые колебания около положений равновесия в отличие от хаотически движущихся атомов жидкости или газа. Напротив, поведение свободных электронов кристалла при определённых условиях очень сходно с поведением атомов газа. Поэтому свободные электроны называют ещё «электронным газом».
Доля свободных электронов в большинстве случаев очень мала. Так обстоит дело у кристаллов, построенных из разноимённых ионов, например, у кристалла поваренной соли. Здесь практически все 10 электронов положительного иона натрия движутся около ядра натрия, и все 18 электронов отрицательного иона хлора движутся около ядра хлора. (Необходимо различать свободные электроны, не имеющие постоянного «хозяина», и электроны, которые при образовании разноимённых ионов по одному на каждый атом перешли от натрия к хлору. Эти последние цепко удерживаются хлором, который не отпускает их «на свободу».)