Ю. В. Ракитин.
Этилена окись
Этиле'на о'кись, этиленоксид, оксиран,
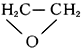
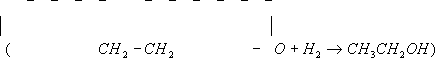
гидрогалогенирование — к соответствующим этиленгалогенгидринам (например,
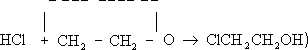
В этих и многих аналогичных реакциях Э. о. является эффективным алкилирующим агентом (с её помощью вводится b-оксиэтильная группа HOCH2 CH2 —), что широко используется в промышленности и лабораторной практике для получения ценных продуктов, например этиленциангидрина (взаимодействием с синильной кислотой ), этиленгликоля и его моноэфиров — целлозольвов (гидратацией и алкоголизом), этаноламинов (реакцией с аммиаком), b-меркаптоэтанола HSC2 CH2 OH и (взаимодействием с сероводородом), b-фенил-этилового спирта (Фриделя — Крафтса реакцией с бензолом). Для Э. о. характерна (также идущая с разрывом связи С—О) полимеризация. Так, при пропускании паров Э. о. при 110—160°С над NaHSO4 образуется её димер — диоксан ; под каталитическим действием третичных аминов или хлорида олова (IV) Э. о. легко полимеризуется (иногда со взрывом) уже при обычной температуре. Полиэтиленоксиды [—CH2 —CH2 —O] n имеют широкий интервал молекулярных масс (от 102 до 107 ). Различают низкомолекулярные полимеры, т. н. полиэтиленгликоли (молекулярная масса до 40 тыс.), и высокомолекулярные (от 500 тыс. до 10 млн.). Полиэтиленгликоли — жидкие или воскообразные продукты, получаемые каталитической полимеризацией Э. о. при 100 — 150°С и используемые в текстильной промышленности (как смачиватели, умягчители и антистатические агенты), в косметике и как компоненты моющих средств. Высокомолекулярные полимеры Э. о. в промышленности получают суспензионной каталитической полимеризацией при 20—50°С; они представляют собой твёрдые продукты с хорошими термопластическими и механическими свойствами, некоторой водорастворимостью; используются как флокулянты, для снижения гидродинамического сопротивления водных потоков, в текстильной промышленности (как загустители). В качестве эмульгаторов и компонентов моющих средств применяются продукты конденсации Э. о. с высшими спиртами (олеиловым, лауриловым, стеариловым), алкилфенолами, например с изооктилфенолом, с жирными карбоновыми кислотами, представляющие собой полиэтиленгликолевые эфиры типа RO (CH2 CH2 O)n —Н, где R — органический радикал, а
Циклические простые эфиры, получаемые из Э. о., — т. н. краунэфиры, широко применяют в органическом синтезе для разъединения ионных пар различных солей в апротонных биполярных растворителях, как, например, краун 18—6 для связывания иона калия. Основные промышленные методы получения Э. о. — каталитическое окисление этилена кислородом воздуха при 200—300°С над катализатором, содержащим металлическое серебро, и дегидрохлорирование этиленхлоргидрина . Важное значение Э. о. имеет также в тонком органическом синтезе: например реакцией её с ацетоуксусным эфиром получают ацетобутиролактон, используемый в производстве витамина B1 и являющийся промежуточным продуктом для получения противомалярийных препаратов. Э. о. токсична: в малых количествах она обладает наркотическим действием, в значительных — приводит к раздражению слизистых оболочек, удушью и отёку лёгких. Предельно допустимая концентрация Э. о. в воздухе — 0,001 мг/л.
Этиленгликоль
Этиленглико'ль, этандиол-1,2, HOCH2 CH2 OH, простейший гликоль , бесцветная вязкая жидкость со сладким вкусом; tпл — 12,3°С, tkип 196°С, плотность 1,113 г/см3 (20°С); смешивается во всех соотношениях с водой, спиртом, ацетоном, плохо растворим в эфире, не растворим в хлороформе, алифатических и ароматических углеводородах; гигроскопичен. Важным свойством Э. является его способность сильно понижать температуру замерзания воды (до — 25°С при 40%-ном содержании Э. в воде и до —40°С при 60%-ном), что широко используется для приготовления антифризов . Подобно другим двухатомным спиртам, Э. образует моно- и дигликоляты, например HOCH2 CH2 ONa и NaOCH2 CH2 ONa, эфиры (простые и сложные) и другие производные, среди которых наибольшую практическую ценность имеют простые моноэфиры HOCH2 CH2 OR (т. н. целлозольвы ), где R — углеводородный радикал, используемые в качестве растворителей, и сложные полиэфиры (—ОСН2 СН2 ОСО—R—CO—) n , например полиэтилентерефталат , применяемые для изготовления синтетического волокна типа лавсан (см. Полиэфирные волокна ). Сложный эфир Э. и азотной кислоты, т. н. нитрогликоль — взрывчатое вещество. Основной промышленный метод получения Э.— гидратация этилена окиси при 10 ат и 190—200°С или при 1 ат и 50—100°С в присутствии 0,1—0,5% серной (или ортофосфорной) кислоты; в качестве побочных продуктов при этом образуются диэтиленгликоль и незначительное количество высших полимергомологов Э. В ограниченных масштабах Э. применяют также как растворитель печатных и некоторых других красок, в производстве чернил и паст для шариковых ручек, в органическом синтезе. Э. токсичен.
М. К. Грачев.