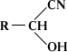
Циангидрины
Циангидри'ны, a-оксинитрилы, нитрилы a-оксикислот, органические соединения, содержащие окси- и цианогруппу у одного атома углерода,
Цианеи
Циане'и (ботанические), то же, что синезелёные водоросли .
Цианея
Циане'я (Cyanea capillata), крупная морская медуза из класса сцифоидных . Края зонтика с восемью двойными лопастями, щупальца собраны в 8 пучков. Окраска тела обычно очень яркая, зонтик желтовато-красный, ротовые лопасти малиновые, щупальца розовые. Диаметр зонтика от нескольких см до 2 м, щупальца достигают в вытянутом состоянии 40 м . На щупальцах большое кол-во стрекательных клеток, служащих для нападения и защиты (между щупальцами Ц. обычно держатся мальки пикши и некоторых др. тресковых рыб, находящие здесь защиту). Обитают Ц. в сев. частях Атлантического и Тихого океанов и в морях Северного Ледовитого океана.

К ст. Цианея.
Цианид калия
Циани'д ка'лия, цианистый калий, KCN. Бесцветные гигроскопичные кристаллы, tкип 635 °С, плотность 1,56 г/см3 (25 °С). Хорошо растворим в воде (41,7% при 25 °С, 55% при 103,3 °С). В водном растворе гидролизуется с выделением HCN; константа гидролиза 2,54×10-5 (25 °С), Проявляет большую склонность к образованию комплексных соединений , например калия гексацианоферроата .
В промышленности Ц. к. получают главным образом нейтрализацией HCN гидроокисью калия КОН. О применении Ц. к. см. Цианиды . Ц. к. очень токсичен. О действии на организм и о технике безопасности при работе с ним см. Синильная кислота .
Лит. см. при ст. Цианиды .
Цианид натрия
Циани'д на'трия, цианистый натрий, NaCN. Бесцветные гигроскопичные кристаллы; tпл 564 °С; плотность 1,5955 г/см3 (20 °С). Кристаллизуется в виде NaCN×2H2 O, выше 34,7 °С — в безводной форме. Хорошо растворим в воде (32,4% при 10 °С, 45,0% при 35 °С). В водных растворах гидролизуется:
NaCN + H2 O Û HCN + NaOH.
Как и KCN, Ц. н. легко образует комплексные соединения. В промышленности Ц. н. получают главным образом нейтрализацией синильной кислоты гидроокисью натрия NaOH. О применении Ц. н. см. Цианиды . Ц. н. очень токсичен. О действии на организм и мерах предосторожности при работе с ним см. Синильная кислота .
Лит. см. при ст. Цианиды .
Цианиды
Циани'ды, соли синильной кислоты . Ц. щелочных металлов MeCN и щёлочноземельных металлов Me (CN)2 (где Me — металл) термически устойчивы, в водных растворах гидролизуются. Ц. тяжёлых металлов термически неустойчивы, в воде, кроме Hg (CN)2 , нерастворимы. При окислении Ц. образуют цианаты (например, 2KCN + O2 ® 2KOCN). Многие металлы при действии избытка цианида калия или цианида натрия дают комплексные соединения , что используется, например, для извлечения золота и серебра из руд (см. Цианирование ):
4NaCN + 2Au+1 /2 O2 + H2 O ® 2Na [Au (CN)2 ] + 2NaOH.
Золото и серебро из раствора выделяют электролитическим осаждением либо при действии металлического цинка. Растворы цианидных комплексов золота, серебра, цинка и др. металлов используют в гальванотехнике для получения покрытий. Ц. применяют в органическом синтезе, например для получения нитрилов , в качестве катализатора (см. Бензоиновая конденсация ). Ц. очень токсичны. О действии на организм и мерах предосторожности при работе с Ц. см. Синильная кислота .
Лит.: Бобков С. С., Смирнов С, К., Синильная кислота, М., 1970; Зильберман Е. Н., Реакции нитрилов, М., 1972; Томилов А. П., Смирнов С. К., Адиподинитрил и гексаметилендиамин, М., 1974; Williams Н. Е., Cyanogen compounds, 2 ed., L., 1948; Migrdichian V., The chemistry of organic cyanogen compounds, N. Y., 1947: Methoden der organischen Chemie. (Houben — Weyl), 4 Aufl., Bd 8, Stuttg., 1952.
С. К. Смирнов.
Цианины
Циани'ны, органические соединения, содержащие два гетероциклических радикала, соединённых цепью из нечётного числа метиновых групп:

где Y, Y' — О, S, Se, CR2 и др.; R, R' — H, алкил; X—CI- , Br- , I- и др.; n = 0—5.
Название Ц. произошло от первого соединения этого класса — ярко-синего цианина (от греч. kyanós — синий). В зависимости от числа метиновых групп в цепи различают цианины (монометинцианины) с n = 0, карбоцианины (триметинцианины) с n = 1, дикарбоцианины (пентаметинцианины) с n = 2 и т.д. Общий метод синтеза Ц. состоит в конденсации четвертичных солей гетероциклических оснований. Ц. относятся к группе полиметиновых красителей .
Лит. см. при ст. Полиметиновые красители .
Цианирование (в гидрометаллургии)
Циани'рование в гидрометаллургии, способ извлечения металлов (главным образом золота и серебра) из руд и концентратов избирательным растворением их в растворах цианидов щелочных металлов. Избирательность растворения достигается слабой концентрацией раствора (0,03—0,3% цианида), благодаря чему он мало взаимодействует с др. компонентами руды. Растворение золота и серебра в цианистом растворе происходит в присутствии растворённого в воде кислорода; повышение его концентрации интенсифицирует процесс (см. Цианиды ). Для предотвращения разложения цианидов в растворы вводят в количестве 0,005—0,02% защитную щёлочь в виде извести или едкого натра.
В основе теории процессов Ц. лежат закономерности кинетики растворения на неоднородной поверхности (при катодной деполяризации кислородом) и диффузионного растворения металлов (при одновременной диффузии цианида и кислорода). Большое значение имеют закономерности взаимодействия реагентов с минералами, учитывающие их состав и структуру.
В промышленности применяют 2 метода Ц.: просачивание (перколяция) растворов через слой мелкораздробленной руды или песков и перемешивание пульпы при её интенсивной аэрации. Из раствора золото и серебро часто осаждаются цинковой пылью.
Развивается сорбционное Ц., совмещающее процессы выщелачивания и извлечения растворённого золота и серебра из пульпы сорбцией анионитами или активированными углями. Этот вид Ц. эффективен при переработке труднофильтруемых шламистых руд.