Извлечение золота при Ц. пульп составляет 90—96%, при расходе цианида натрия 0,25—3 кг/т и защитной щёлочи 0,5—5 кг/т.
Впервые растворение золота и серебра в цианистых растворах изучил в 1843 П. Р. Багратион . Его исследования дополнили Ф. Эльснер (Германия, 1846) и М. Фарадей (1856). В производственную практику Ц. вошло в начале 90-х гг. 19 в. (патенты Дж. Мак-Артура и братьев Р. и У. Форрест, Великобритания, 1887 и 1888). См. также Благородные металлы , Гидрометаллургия .
Лит.: Масленицкий И. Н., Чугаев Л. В., Металлургия благородных металлов, М., 1972; Основы металлургии, т. 5, М., 1968.
Цианирование (в сталелитейном пр-ве)
Циани'рование стали, разновидность химико-термической обработки , заключающаяся в комплексном диффузионном насыщении поверхностного слоя стали углеродом и азотом в расплавах, содержащих цианистые соли, при 820—860 °С (среднетемпературное Ц.) или при 930—950 °С (высокотемпературное Ц.). Основная цель Ц. — повышение твёрдости, износостойкости и предела выносливости стальных изделий. В процессе Ц. цианистые соли окисляются с выделением атомарных углерода и азота, которые диффундируют в сталь. При среднетемпературном Ц. образуется цианированный слой глубиной 0,15—0,6 мм с 0,6—0,7% С и 0,8—1,2% N, при высокотемпературном (этот вид Ц. часто применяют вместо цементации ) — слой глубиной 0,5—2 мм с 0,8—1,2% С и 0,2—0,3% N. После Ц. изделие подвергают закалке и низкому отпуску. Недостатки Ц.: высокая стоимость, ядовитость цианистых солей и необходимость в связи с этим принятия специальных мер по охране труда и окружающей природы. Ц. отличается от нитроцементации , при которой насыщение азотом и углеродом ведётся из газовой среды.
Лит.: Минкевич А. Н., Химико-термическая обработка металлов и сплавов, 2 изд., М., 1965; Лахтин Ю. М., Металловедение и термическая обработка металлов, 2 изд., М., 1977.
Ю. М. Лахтин.
Цианистый водород
Циа'нистый водоро'д, цианисто-водородная кислота, HCN, то же, что синильная кислота .
Цианистый калий
Циа'нистый ка'лий, то же, цианид калия .
Цианистый натрий
Циа'нистый на'трий, то же, цианид натрия .
Цианкобаламин
Цианкобалами'н, витамин B12 H88 CoN14 O14 P; кобальт-корриновый комплекс, в котором атом кобальта соединён с цианогруппой, нуклеотидным остатком и с четырьмя восстановленными пиррольными кольцами. Молекулярная масса 1355,40. Тёмно-красные кристаллы, растворимые в воде и полярных органических растворителях. В кристаллическом виде впервые получен из печени крупного рогатого скота. Строение установлено А. Тоддом , Д. Кроуфут-Ходжкин и сотрудниками. Первоисточник Ц. в природе — микроорганизмы (Ц. синтезируется некоторыми бактериями, актиномицетами, синезелёными водорослями). Ц. обнаружен почти во всех тканях животных. В тканях высших растений, как правило, не встречается (исключение — клубеньки бобовых). У жвачных животных Ц. в достаточном количестве синтезируется микрофлорой кишечника, рубца. У человека и некоторых высших животных (птиц, свиней и др.) синтез Ц. микрофлорой кишечника незначителен, поэтому витамин B12 должен поступать в организм с пищей. Потребность в Ц. человека — около 5 мкг в сутки. Основной источник Ц. — печень, почки, рыбная мука, молоко. Ц. в форме коферментов — метилкобаламин и дезоксиаденозилкобаламин — участвует в ферментативных реакциях, обеспечивающих кроветворную функцию организма, способствует нормализации функции печени, благоприятно влияет на регенерацию нервных волокон. Получают Ц. микробиологическим синтезом, используя для ферментации пропионовокислые бактерии.
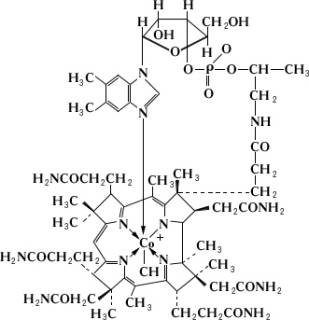
Витамин B12 применяют для лечения пернициозной и др. анемий, а также заболеваний центральной и периферической нервной систем, печени и т.д. Назначают в растворах внутримышечно. См. также Витамины , Анемия , Кобаламины .
Лит.: Смит Л., Витамин B12 , пер. с англ., М., 1962; Friedrich W., Vitamin B12 und verwandte corrinoide, 3 Aufl., Stuttg., 1975.
И. П. Рудакова.
Цианобактерии
Цианобакте'рии, синезелёные бактерии, термин, применяемый с 70-х гг. 20 в. главным образом в микробиологической литературе для обозначения синезелёных водорослей . Основанием для введения термина «Ц.» послужило сходство строения клеток (их ядерного, рибосомального и фотосинтезирующего аппаратов, клеточной стенки и др. структур), наличие общих специфических компонентов (муреина в клеточной стенке, поли-b-оксибутирата как запасного вещества) и близость генетических свойств Ц. с др. представителями прокариотов — бактериями.
Циановая кислота
Циа'новая кислота', равновесная смесь двух таутомерных форм — Ц. к. (I) и изо-Ц. к. (II) — с преобладанием в обычных условиях последней:
(I) H—O—CºN Û H—N=C=O (II).
Ц. к. — бесцветная легкоподвижная жидкость с резким запахом, tпл — 80 °С, tкип 23,6 °С, плотность 1,14 г/см3 (0°С). Ц. к. хорошо растворима в воде, эфире. Водный раствор Ц. к. — довольно сильная кислота (константа диссоциации К = 1×10-4 ). Жидкая Ц. к. самопроизвольно (уже при 0 °С) полимеризуется (при 20 °С иногда со взрывом); продукты полимеризации: циклический тример (HOCN)3 — циануровая кислота и линейный полимер (HOCN) n — циамелид. В разбавленных водных растворах Ц. к. легко гидролизуется (особенно быстро в присутствии минеральных кислот):
HOCN + H2 O ® CO2 + NH3 .
Ц. к. может быть получена каталитическим окислением синильной кислоты (при 560—640 °С) или термической деполимеризацией циануровой кислоты в токе CO2 . Ц. к. — промежуточный продукт в промышленном синтезе меламина из мочевины. Среди производных Ц. к. наибольшее практическое значение имеют хлористый циан , цианамид кальция и цианаты .
Лит. см. при ст. Цианиды .