и расходах до нескольких м/сек. Необходимо обеспечение минимальной массы двигателя. См. также ст. Реактивный двигатель, Ракетный двигатель.
Лит.: Циолковский К. Э., Исследование мировых пространств реактивными приборами. Калуга, 1926; Добровольский М. В., Жидкостные ракетные двигатели, М., 1968; Алемасов В. Е., Дрегалин А. Ф., Тишин А. П., Теория ракетных двигателей, 2 изд., М., 1969; Петрович Г. В., Ракетные двигатели ГДЛ-ОКБ. 1929—1969, М., 1969; Волков Е. Б., Головков Л. Г., Сырицын Т. Л., Жидкостные ракетные двигатели, М., 1970; Rocket propulsion, Amst. — L. — N. Y., 1960.
С. З. Копелев.
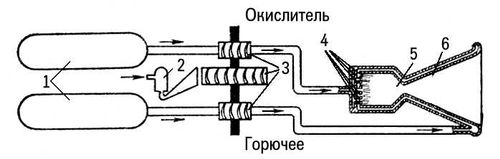
Рис. 2. Схема подачи топлива в жидкостном ракетном двигателе с турбонасосным агрегатом: 1 — топливные баки; 2 — парогенератор; 3 — турбонасосный агрегат; 4 — форсунки; 5 — камера сгорания; 6 — сопло.
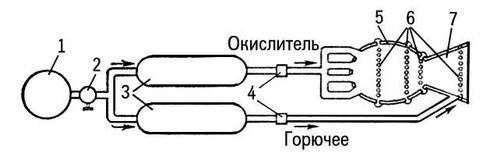
Рис. 3. Схема жидкостного ракетного двигателя со смешанным охлаждением: 1 — баллон со сжатым газом; 2 — редуктор давления; 3 — топливные баки; 4 — клапаны; 5 — камера сгорания; 6 — пояса подачи горючего для внутреннего охлаждения; 7 — сопло.
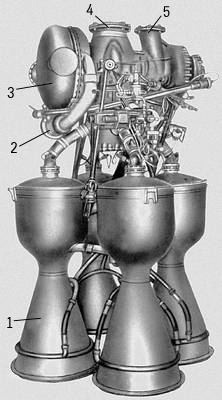
Рис. 1. Кислородо-керосиновый 4-камерный жидкостный ракетный двигатель РД-107 с тягой 1 Мн (102 тс) первой ступени ракеты-носителя «Восток» (ГДЛ-ОКБ, 1954-57): 1 — рулевые камеры сгорания; 2 — основные камеры сгорания; 3 — силовая рама; 4 — газогенератор; 5 — теплообменник на турбине; 6 — насос окислителя; 7 — насос горючего.
Жидкость
Жи'дкость, агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д. С другой стороны, взятая в достаточном количестве Ж. принимает форму сосуда, в котором находится. Принципиальная возможность непрерывного перехода Ж. в газ также свидетельствует о близости жидкого и газообразного состояний.
По химическому составу различают однокомпонентные, или чистые. Ж. и двух- или многокомпонентные жидкие смеси (растворы). По физической природе Ж. делятся на нормальные (обычные), жидкие кристаллы с сильно выраженной анизотропией (зависимостью свойств от направления) и квантовые жидкости — жидкие 4He, 3He и их смеси — со специфическими квантовыми свойствами при очень низких температурах. Нормальные чистые Ж. имеют только одну жидкую фазу (т. е. существует один единственный вид каждой нормальной Ж.). Гелий 4He может находиться в двух жидких фазах — нормальной и сверхтекучей, а жидкокристаллические вещества — в нормальной и одной или даже двух анизотропных фазах.
Общим для всех нормальных Ж., в том числе и для смесей, является их макроскопическую однородность И изотропность при отсутствии внешних воздействий. Эти свойства сближают Ж. с газами, но резко отличают их от анизотропных кристаллических твёрдых тел. Аморфные твёрдые тела (например, стекла), с современной точки зрения, являются переохлажденными Ж. (см. Аморфное состояние) и отличаются от обычных Ж. только численными значениями кинетических характеристик (существенно большей вязкостью и др.). Область существования нормальной жидкой фазы ограничена со стороны низких температур фазовым переходом в твёрдое состояние — кристаллизацией или (в зависимости от величины приложенного давления) фазовым переходом в сверхтекучее состояние для 4He и в жидко-анизотропное состояние для жидких кристаллов. При давлениях ниже критического давления рк нормальная жидкая фаза ограничена со стороны высоких температур фазовым переходом в газообразное состояние — испарением. При давлениях р > рк фазовый переход отсутствует и по своим физическим свойствам Ж. в этой области неотличима от плотного газа. Наивысшая температура Tk, при которой ещё возможен фазовый переход Ж. — газ, называется критической. Значения pk и Tk определяют критическую точку чистой Ж., в которой свойства Ж. и газа становятся тождественными. Наличие критической точки для фазового перехода Ж. — газ позволяет осуществить непрерывный переход из жидкого состояния в газообразное, минуя область, где газ и Ж. сосуществуют (см. Критическое состояние). Т. о., при нагревании или уменьшении плотности свойства Ж. (теплопроводность, вязкость, самодиффузия и др.), как правило, меняются в сторону сближения со свойствами газов. Вблизи же температуры кристаллизации большинство свойств нормальных Ж. (плотность, сжимаемость, теплоёмкость, электропроводность и т. д.) близки к таким же свойствам соответствующих твёрдых тел. В табл. приведены значения теплоёмкости при постоянном давлении (Ср) ряда веществ в твёрдом и жидком состояниях при температуре кристаллизации. Малое различие этих теплоёмкостей показывает, что тепловое движение в Ж. и твёрдых телах вблизи температуры кристаллизации имеет примерно одинаковый характер.
Теплоёмкость некоторых веществ [в дж/(кг·К)], при температуре кристаллизации
| Na | Hg | Pb | Zn | Cl | NaCl | |
| Ср | 1382 | 138 | 146 | 461 | 620 | 1405 |
| Ср | 1386 | 138 | 155 | 542 | 1800 | 1692 |
Молекулярная теория Ж. По своей природе силы межмолекулярного взаимодействия в Ж. и кристаллах одинаковы и имеют примерно одинаковые величины. Наличие в Ж. сильного межмолекулярного взаимодействия обусловливает, в частности, существование поверхностного натяжения на границе Ж. с любой др. средой. Благодаря поверхностному натяжению Ж. стремится принять такую форму, при которой её поверхность (при данном объёме) минимальна. Небольшие объёмы Ж. имеют обычно характерную форму капли. В отсутствии внешних сил, когда действуют только межмолекулярные силы (например, в условиях невесомости), Ж. приобретает форму шара. Влияние поверхностного натяжения на равновесие и движение свободной поверхности Ж., границ Ж. с твёрдыми телами или границ между несмешивающимися Ж. относится к области капиллярных явлений.
Фазовое состояние вещества зависит от физических условий, в которых оно находится, главным образом от температуры Т и давления р. Характерной определяющей величиной является зависящее от температуры и давления отношение e(Т, р) средней потенциальной энергии взаимодействия молекул к их средней кинетической энергии. Для твёрдых тел e (Т, р) >> 1; это значит, что силы межмолекулярного взаимодействия велики и удерживают молекулы (атомы, ионы) вблизи равновесных положений — узлов кристаллической решётки, несмотря на тепловое движение частиц. В твёрдых телах тепловое движение имеет характер коллективных колебаний атомов (ионов) около узлов кристаллической решётки.