Гидранты
Гидра'нты (зоологическое), многочисленные бокаловидные особи, сидящие на общем стволе и составляющие колонии бесполого поколения (полипы) водных кишечнополостных животных — гидроидов.
Гидраргиллит
Гидраргилли'т (от греч. hydor —вода и argillos — белая глина), гиббсит, минерал, химический состав — А1[ОН]3. Содержит 65,4% глинозёма (Al2O3); известны примеси Fe3+ и Ga3+, замещающие в структуре A13+. Кристаллизуется в моноклинной системе; кристаллическая структура слоистая, сложена из двулистных пакетов (OH), в середине которых размещены ионы A13+. По слабым межпакетным связям проходит хорошая спайность. Г. образует мелкие тонкопластинчатые, обычно бесцветные с перламутровым блеском кристаллики, а также порошковатые массы и корочки с радиально-лучистой или чешуйчатой микроструктурой. Твёрдость по минералогической шкале 2,5—3,5; плотность 2300—2400 кг/м3. Г. обычно образуется при выветривании пород, богатых глинозёмом. Вместе с др. гидроокислами алюминия (диаспор, бёмит) и железа Г. входит в состав бокситовых руд. Гидраргиллитовые бокситы относятся к лучшим алюминиевым рудам.
Гидрастис
Гидра'стис (Hydrastis), род травянистых многолетних растений семейства лютиковых, иногда выделяемый в семейство гидрастиевых. 2 вида на востоке Северной Америки и в Восточной Азии. Г. канадский, или желтокорень, золотая печать (Н. canadensis), — лекарственное северо-американское растение, культивируемое в средней полосе Европейской части СССР и на Украине. Корневище на изломе золотисто-жёлтое, снаружи со следами отмерших стеблей, имеющих вид печати. Стебель высотой до 30 см. Цветки одиночные, с чашечковидным околоцветником из 3 зеленовато-белых листочков; тычинки и пестики многочисленные. Плод ягодообразный, красный.
Корневище содержит алкалоиды гидрастин, берберин и др., применяемые как кровоостанавливающие средства.
Лит.: Атлас лекарственных растений СССР, М., 1962.
Т. В. Егорова.
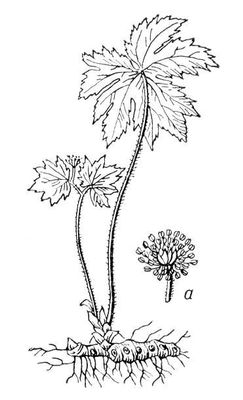
Гидрастис канадский; а — цветок.
Гидратация
Гидрата'ция (от греч. hydor — вода), процессы связывания воды химическими веществами. Различают несколько видов Г.
Г. окислов приводит к гидроокисям, представляющим собой щёлочи, кислоты или амфотерные соединения. Так, присоединение воды к окиси кальция даёт гидроокись кальция (в технике этот процесс называется «гашение извести»):
СаО + H2O = Ca (OH)2.
Г. серного ангидрида в промышленности чают серную кислоту, а окислов азота — азотную кислоту:
SO2 + H2O = H2SO4,
3NO2 + H2O = 2HNO3 + NO.
При Г. трёхокиси мышьяка образуется слабая мышьяковистая кислота, имеющая амфотерные свойства:
As2O3 + 3H2O = 2H3AsO3.
Г. органических соединений происходит по кратным связям; в случае циклических соединений Г. приводит к раскрытию циклов. Обычно эти реакции происходят в присутствии щелочей, кислот или гетерогенных катализаторов (каталитическая Г.). Г. этого типа играет огромную роль в препаративной органической химии и промышленности органического синтеза. Так, в результате прямой Г. олефинов получают спирты, например этиловый спирт из этилена:
CH2 = CH2 + H2O ® CH3CH2OH.
Г. ацетилена приводит к ацетальдегиду (реакция Кучерова) (промежуточный продукт — неустойчивый виниловый спирт):
CH º CH + H2O ® [СН2=СН—ОН] ® CH3CHO.
В результате Г. кетена образуется уксусная кислота, а окиси этилена — этиленгликоль:
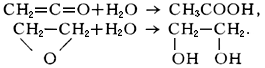
В перечисленных примерах вода реагирует таким образом, что происходит разрыв связи между атомом водорода и группой OH.
Многие неорганические и некоторые органические вещества образуют с водой твёрдые кристаллогидраты, постоянного состава, которые ведут себя как индивидуальные химические соединения. Так, безводный сульфат меди CuSO4 бесцветен; из его водных растворов кристаллизуется ярко-синий гидрат CuSO4·5H2O — медный купорос, при нагревании которого образуется сначала голубой CuSO4·3H2O, затем CuSO4·H2O белого цвета; при 258°С соль полностью обезвоживается. К этому же типу относится Г. молекул в растворах с образованием гидратов различного состава, находящихся в равновесии друг с другом и водой; например, при растворении спирта образуются гидраты с 3,4 и 8 молекулами H2O. При растворении электролитов происходит Г. ионов, затрудняющая ассоциацию последних. Энергия Г. в значительной степени компенсирует энергию диссоциации электролита; т. о., Г. ионов является одной из главных причин электролитической диссоциации в водных растворах. Образование кристаллогидратов и Г. молекул и ионов в растворах являются частными случаями сольватации, т. е. присоединения молекул растворителя. К Г. относят также процессы, приводящие к связыванию воды за счёт адсорбционных сил (см. Адсорбция). См. также Вода.
В биологических системах при Г. происходит присоединение (связывание) воды различными субстратами организма. Вода, входящая в образующиеся при Г. гидратные оболочки, составляет основное количество т. н. связанной воды протоплазмы клетки. С Г. связаны многие биологические процессы. Так, Г. ионов влияет на их проникновение в клетку, а Г. белков изменяет некоторые их свойства — в частности ферментативную активность.
Процесс, обратный Г., т. е. потеря связанной веществами воды, называется дегидратацией. Г. и дегидратация постоянно происходят в процессах обмена веществ, в частности обмена воды, в организмах.
Гидратообразование
Гидратообразова'ние в природном газе. Многие компоненты природного газа (метан, этан, пропан, изобутан, углекислый газ, азот, сероводород) в соединении с водой образуют т. н. газовые гидраты — твёрдые кристаллические вещества (напоминающие по внешнему виду спрессованный снег), которые при высоких давлениях существуют при положительных температурах.
По структуре «газовые гидраты» — соединения включения (клатраты), которые образуются путём внедрения в пустоты кристаллических структур, составленных из молекул H2O, молекул газа (М). Общая формула газовых гидратов — М·nH2O, где значение n изменяется от 5,75 до 17 в зависимости от состава газа и условий образования гидратов.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с Г. на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли, 30%-ный раствор CaCl2), а также поддерживают температуру потока газа выше температуры Г. с помощью подогревателей, теплоизоляцией трубопроводов и подбором режима эксплуатации, обеспечивающего максимальную температуру газового потока. Для предупреждения Г. в магистральных газопроводах наиболее эффективна газоосушка. Г. используется для опреснения морской воды (см. Опреснение воды). Запатентован также ряд способов хранения природных и инертных (Ar, Kr, Xe) газов в виде гидратов. В 1970 советскими учёными доказана принципиальная возможность существования в районах распространения многолетней мерзлоты месторождений природного газа в виде гидратов. Создание эффективных методов поисков и эксплуатации таких месторождений позволит значительно увеличить газовые ресурсы.