Бензоилхлорид
Бензоилхлори'д, хлористый бензоил, органическое соединение C6 H5 COCl; бесцветная жидкость с резким запахом, дымящая на воздухе; tпл — - 1°С; tkип 197,2°С; плотность 1212,2 кг/м3 (1,2122 г/см3 ) при 20°С; растворяется в эфире, бензоле и др. органических растворителях. Б. — хлорангидрид бензойной кислоты ; при его гидролизе водой образуется эта кислота, причём скорость гидролиза возрастает при нагревании и в присутствии щелочей. При восстановлении Б. образуется бензойный альдегид ; при взаимодействии с аминами — бензамиды, представляющие собой кристаллические вещества.
Получают Б. частичным гидролизом бензотрихлорида C6 H5 CCl3 , а также действием хлорангидридов минеральных кислот (PCI5 , PCl3 , SOCl2 , SO2 CL2 ) на бензойную кислоту. Б. широко применяют для бензоилирования (введения группы C6 H5 CO) аминов, спиртов, фенолов, в производстве ангидрида бензойной кислоты (также бензоилирующего агента), бензоила перекиси и индигоидных красителей. Пары Б. вызывают слезотечение.
Бензоиновая конденсация
Бензои'новая конденса'ция, образование a-оксикетонов (ацилоинов), содержащих группировку —СН (ОН) СО—, из двух молекул альдегидов: 2RCHO ® RCOCH (OH) R. Специфическим катализатором конденсации служит CN-ион (например, NaCN, KCN). Эта реакция характерна в основном для ароматических альдегидов, а также для некоторых гетероциклических альдегидов ароматического характера, например фурфурола; её применяют для получения бензоина из бензойного альдегида (отсюда название).
Бензоин, органическое соединение C6 H5 COCH (OH) C6 H5 , — белое кристаллическое вещество; tпл 133—137°С; tkип 343—344°С. Применяют бензоин в органическом синтезе, как эталон в калориметрии и др.
Бензойная кислота
Бензо'йная кислота', простейшая ароматическая кислота, C6 H5 COOH; бесцветные блестящие кристаллы. Впервые выделена возгонкой в начале 17 в. из бензойной смолы (росного ладана), отсюда и получила название. Температура плавления 122°С. Б. к. хорошо растворяется в органических растворителях, в воде — плохо; легко возгоняется; перегоняется с водяным паром. Получают Б. к. окислением толуола азотной или хромовой кислотой, а также декарбоксилированием фталевой кислоты.
Б. к. в виде сложных эфиров и солей содержится в различных природных эфирных маслах, например гвоздичном. В медицине её применяют при кожных заболеваниях наружно как антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, а натриевую соль Б. к. — как отхаркивающее средство. Кроме того, натриевую соль Б. к. используют при консервировании пищевых продуктов. Сложные эфиры Б. к. (от метилового до амилового), обладающие сильным запахом, применяют в парфюмерной промышленности. Различные производные Б. к., например хлор- и нитробензойные кислоты, широко применяют для синтеза красителей.
Бензойная смола
Бензо'йная смола', росный ладан, быстро затвердевающая на воздухе смола, получаемая путём надрезов ствола и ветвей стираксового дерева (Styrax benzoin) семейства стираксовых , дикорастущего и разводимого в Юго-Восточной Азии и на островах Малайского архипелага. Имеет приятный запах благодаря присутствию в ней ванилина, коричной и (у некоторых сортов) бензойной кислот. Используется в парфюмерной промышленности.
Бензойный альдегид
Бензо'йный альдеги'д, бензальдегид, органическое соединение C6 H5 CHO; бесцветная маслянистая жидкость с запахом горького миндаля; tпл —26°С; tkип 179°С; в 100 г воды растворяется 0,3 г Б. а.; смешивается со спиртом, эфиром и др. органическими растворителями. Б. а. легко окисляется (даже на воздухе) до бензойной кислоты C6 H5 COOH, однако добавка 0,1% гидрохинона предотвращает (ингибирует) окисление. Б. а. присоединяет по СО-связи бисульфит натрия, синильную кислоту и др.; при кипячении Б. а. с раствором щёлочи образуются бензиловый спирт и бензойная кислота (см. Канниццаро реакция ); в присутствии CN-иона Б. а. вступает в бензоиновую конденсацию . При конденсации Б. а. с ацетальдегидом под действием щёлочи образуется коричный альдегид C6 H5 CH=CHCHO, с фенолами и ароматическими аминами — производные трифенилметана.
Б. а. в виде гликозида амигдалина, расщепляющегося водой на Б. а., глюкозу и синильную кислоту, содержится в косточках горького миндаля, абрикосов, персиков и др. Б. а. получают окислением толуола или гидролизом бензилиденхлорида C6 H5 CHCl2 ; большое значение имеет метод получения Б. а. из бензола и окиси углерода под действием хлористого алюминия. Б. а. применяют как душистое вещество, для синтеза коричного альдегида, бензоина, в производстве красителей трифенилметанового ряда и др.
Я. Ф. Комиссаров.
Бензол
Бензо'л, органическое соединение C6 H6 , простейший ароматический углеводород ; подвижная бесцветная летучая жидкость со своеобразным нерезким запахом; tnл 5,5°C; tkип 80,1°С; плотность 879,1 кг [м3 (0,8791 г/см3 ) при 20°С; n 20 D 1,5011. С воздухом в объёмной концентрации 1,5—8% Б. образует взрывоопасные смеси. Б. смешивается во всех соотношениях с эфиром, бензином и др. органическими растворителями; в 100 г Б. при 26°С растворяется 0,054 г воды; с водой образует азеотропную (постоянно кипящую) смесь (91,2% Б. по массе) с tkип 69,25°С.
Б. открыт М. Фарадеем . (1825), который выделил его из жидкого конденсата светильного газа; в чистом виде Б. получен в 1833 Э. Мичерлихом , сухой перегонкой кальциевой соли бензойной кислоты (отсюда название).
В 1865 Ф. А. Кекуле предложил для Б. формулу строения I, соответствующую циклогексатриену — замкнутую цепь из 6 атомов углерода с чередующимися простыми и двойными связями. Формулой Кекуле довольно широко пользуются, хотя накоплено много фактов, свидетельствующих о том, что Б. не обладает строением циклогексатриена. Так, давно установлено, что орто-дизамещённые Б. (например, 1,2 и 1,6) существуют лишь в одной форме, тогда как формула Кекуле допускает изомерию таких соединений (заместители у атомов углерода, связанных простой или двойной связью). В 1872 Кекуле дополнительно ввёл гипотезу о том, что связи в Б. постоянно и очень быстро перемещаются, осциллируют. Были предложены и др. формулы строения Б., однако они не получили признания.
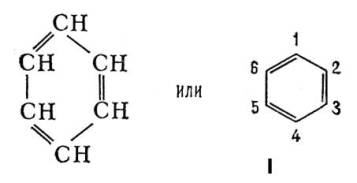
Химические свойства Б. формально в некоторой степени соответствуют формуле (1). Так, в определённых условиях к молекуле Б. присоединяются 3 молекулы хлора или 3 молекулы водорода; Б. образуется при конденсации 3 молекул ацетилена. Однако для Б. характерны в основном не реакции присоединения, типичные для ненасыщенных соединений, а реакции электрофильного замещения. Кроме того, бензольное ядро очень устойчиво к действию окислителей, например перманганата калия, что также противоречит наличию в Б. локализованных двойных связей. Особые, т. н. ароматические, свойства Б. объясняются тем, что все связи в его молекуле выравнены, т. е. расстояния между соседними атомами углерода одинаковы и равны 0,14 нм (1,40