Периодическая таблица элементов
Итак, мы изложили правила расселения электронов по энергетическим уровням, изображённым на рис. 11.1. Теперь эти правила будут использоваться для понимания многочисленных свойств атомов и Периодической таблицы элементов. Кроме того, точно такие же правила будут очень важны при обсуждении молекул в последующих главах. Однако сначала нам необходимо познакомиться с Периодической таблицей (рис. 11.4).
В Периодической таблице каждому элементу соответствует клетка. В этой клетке записан символ элемента, а также его атомный номер. Атомный номер — это число положительно заряженных протонов в ядре элемента. Для нейтрального атома (в отличие от положительно или отрицательно заряженного иона) атомный номер — это также число отрицательно заряженных электронов. О строении Периодической таблицы будет во всех подробностях рассказано далее. В её левом верхнем углу расположен водород (символ H, атомный номер 1). В правом верхнем углу находится гелий (символ He, атомный номер 2). Под водородом располагается литий (символ Li, атомный номер 3).
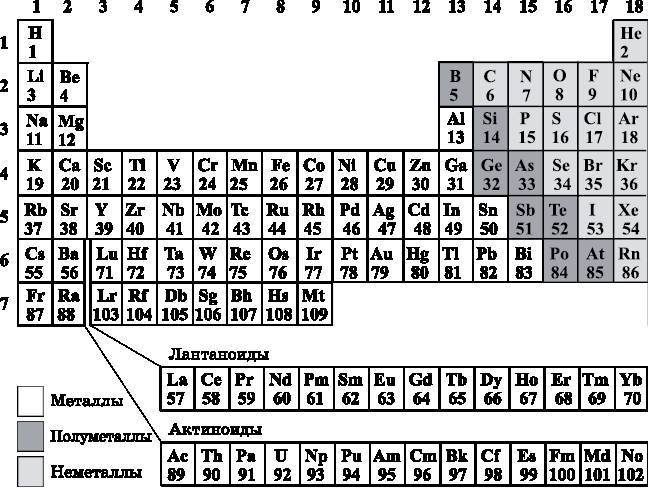
Рис. 11.4. Периодическая таблица элементов
Многие символы являются просто аббревиатурами названий. Но это не всегда так. Например, свинцу (элемент 82) соответствует буквенный символ Pb, производный от латинского названия свинца plumbum. Поскольку по символам не всегда легко понять, как называется элемент, в табл. 11.1 приведены названия, символы и атомные номера элементов. Названия элементов в таблице упорядочены по алфавиту. Если по буквенному символу элемента вы не можете определить его название, просматривайте сверху вниз колонку символов, пока не найдёте нужный.
Таблица 11.1. Список элементов (в алфавитном порядке названий)
Элемент, Символ, Атомный №
Азот N 7
Актиний Ac 89
Алюминий Al 13
Америций Am 95
Аргон Ar 18
Астат At 85
Барий Ba 56
Бериллий Be 4
Берклий Bk 97
Бор B 5
Борий Bh 107
Бром Br 35
Ванадий V 23
Висмут Bi 83
Водород H 1
Вольфрам W 74
Гадолиний Gd 64
Галлий Ga 31
Гафний Hf 72
Гелий He 2
Германий Ge 32
Гольмий Ho 67
Дармштадтий Ds 110
Диспрозий Dy 66
Дубний Db 105
Европий Eu 63
Железо Fe 26
Золото Au 79
Индий In 49
Иод I 53
Иридий Ir 77
Иттербий Yb 70
Иттрий Y 39
Кадмий Cd 48
Калий K 19
Калифорний Cf 98
Кальций Ca 20
Кислород O 8
Кобальт Co 27
Коперниций Cn 112
Кремний Si 14
Криптон Kr 36
Ксенон Xe 54
Кюрий Cm 96
Лантан La 57
Ливерморий Lv 116
Литий Li 3
Лоуренсий Lr 103
Лютеций Lu 71
Магний Mg 12
Марганец Mn 25
Медь Cu 29
Мейтнерий Mt 109
Менделевий Md 101
Молибден Mo 42
Мышьяк As 33
Натрий Na 11
Неодим Nd 60
Неон Ne 10
Нептуний Np 93
Никель Ni 28
Ниобий Nb 41
Нобелий № 102
Олово Sn 50
Осмий Os 76
Палладий Pd 46
Платина Pt 78
Плутоний Pu 94
Полоний Po 84
Празеодим Pr 59
Прометий Pm 61
Протактиний Pa 91
Радий Ra 88
Радон Rn 86
Резерфордий Rf 104
Рений Re 75
Рентгений Rg 111
Родий Rh 45
Ртуть Hg 80
Рубидий Rb 37
Рутений Ru 44
Самарий Sm 62
Свинец Pb 82
Селен Se 34
Сера S 16
Серебро Ag 47
Сиборгий Sg 106
Скандий Sc 21
Стронций Sr 38
Сурьма Sb 51
Таллий Tl 81
Тантал Ta 73
Теллур Te 52
Тербий Tb 65
Технеций Tc 43
Титан Ti 22
Торий Th 90
Тулий Tm 69
Углерод C 6
[Унунпентий] Uup 115
[Унунтрий] Uut 113
Уран U 92
Фермий Fm 100
Флеровий Fl 114
Фосфор P 15
Франций Fr 87
Фтор F 9
Хассий Hs 108
Хлор Cl 17
Хром Cr 24
Цезий Cs 55
Церий Ce 58
Цинк Zn 30
Цирконий Zr 40
Эйнштейний Es 99
Эрбий Er 68
В Периодической таблице (см. рис. 11.4) отмечены металлы (белый тон), полуметаллы (полупроводники, тёмно-серый тон) и неметаллы (светло-серый тон). Полуметаллы — эта полоса между металлами (к которым относится большинство элементов) и неметаллами, которые располагаются в верхней правой части таблицы. В нижней части таблицы находятся два ряда элементов, называемых лантаноидами и актиноидами. Лантаноиды начинается с элемента лантана (La), а актиноиды — с актиния (Ac). Они заполняют пробел, отмеченный в таблице. Эти два ряда атомов, в которых задействованы f-орбитали, помещают под остальной таблицей, чтобы она не становилась слишком широкой.
Прежде чем перейти к рассмотрению свойств элементов, мы вкратце пройдёмся по первым двум строкам Периодической таблицы, чтобы почувствовать её структуру и понять, что такое «заполненная оболочка» в применении к электронной конфигурации. Затем мы обсудим, как использовать таблицу для понимания свойств элементов.
Структура Периодической таблицы
С учётом диаграммы энергетических уровней (см. рис. 11.1) и трёх правил заселения энергетических уровней электронами водород (символ H, атомный номер 1) имеет один электрон на 1s-орбитали согласно правилу о том, что самые нижние уровни заселяются первыми, если это не нарушает принцип Паули. Водород находится в верхнем левом углу Периодической таблицы. Это первый элемент в строке 1. Следующий элемент — это гелий (He, 2). На его 1s-орбитали находятся два электрона с противоположными спинами (стрелка вверх и стрелка вниз, как показано на рис. 11.2). Эта конфигурация удовлетворяет принципу Паули и правилу о том, что позиции с наименьшей энергией занимаются первыми, который перекрывает правило Хунда, поскольку потребовалось бы слишком много энергии, чтобы поместить второй электрон гелия на энергетический уровень 2s (см. рис. 11.1). Гелий находится в верхнем правом углу Периодической таблицы — он завершает первую строку. Эта первая строка состоит из двух элементов — H и He с электронами на уровне n=1. Строки таблицы также называют периодами. Гелий завершает первый период. Говорят, что гелий имеет заполненную (или замкнутую) электронную оболочку, поскольку это старший элемент, все электроны которого имеют n=1.
Следующий элемент — это литий (Li, 3). Он имеет три электрона. Первые два электрона занимают энергетический уровень 1s, подчиняясь правилу о том, что сначала заселяется самый нижний доступный уровень. Третий электрон не может разместиться на 1s-орбитали, поскольку это нарушало бы принцип Паули. Поэтому третий электрон занимает 2s-орбиталь. В Периодической таблице Li располагается под H. H — это первый элемент с электроном, находящимся в оболочке n=1. Li — это первый элемент второго периода, соответствующего оболочке с n=2.
Следующий элемент — это бериллий (Be, 4). Четвёртый электрон также занимает 2s-орбиталь. Это самое низкое энергетическое состояние, не нарушающее принцип Паули. Далее следует бор (B, 5) с пятью электронами. Пятый электрон не может занять 2s-орбиталь, поскольку это нарушило бы принцип Паули, утверждающий, что на одной орбитали может находиться не более двух электронов, которые должны иметь противоположные спины (спиновое квантовое число s=+½ или s=−½). Поэтому пятый электрон заселяется на 2p-орбиталь, а на какую именно из 2p-орбиталей, не имеет значения. Следуя рис. 11.3, будем считать, что это 2px-орбиталь. Между Be и B в таблице есть разрыв. Причина его появления прояснится далее, когда мы будем обсуждать четвёртый период.