Эти шесть атомных pz-орбиталей объединяются и образуют молекулярные орбитали. Без нарушения принципа Паули эти атомные орбитали могут содержать максимум 12 электронов. Поэтому шесть атомных орбиталей образуют суперпозицию и дают шесть молекулярных орбиталей (МО), которые также могут вмещать максимум 12 электронов. Эти МО не связаны с конкретным атомом или даже конкретной парой атомов. Они растянуты на всю систему из шести атомов углерода.
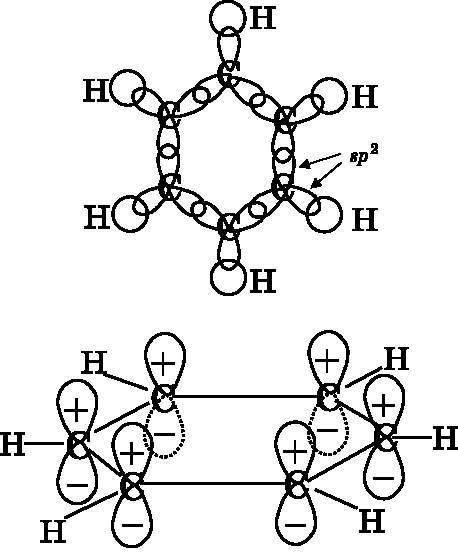
Рис. 18.3. Вверху: бензол и
Обсуждая молекулу водорода в связи с рис. 12.6, мы выяснили, что две атомные орбитали в ней объединяются и образуют две молекулярные орбитали — связывающую и разрыхляющую. В главе 13 мы разбирались с более крупными двухатомными молекулами, такими как F2, O2 и N2. У этих элементов каждый атом имеет три p-орбитали, а шесть атомных орбиталей при объединении дают шесть π-МО — три связывающие и три разрыхляющие (см. рис. 13.5). Некоторые из этих двухатомных
Связывающие и разрыхляющие молекулярные орбитали
В бензоле шесть атомных pz-орбиталей объединяются и образуют три связывающие МО и три разрыхляющие МО, как показано на рис. 18.4. Шесть 2pz-орбиталей углерода, по одной у каждого атома, обладают одинаковой энергией. Это обозначено шестью близко расположенными линиями в левой части рис. 18.4. Они объединяются и образуют шесть МО с энергетическими уровнями, изображенными в правой части рисунка. Энергия трех из этих МО ниже, чем у атомных pz-орбиталей, — это связывающие МО. Другие три МО обладают энергией более высокой, чем у атомных орбиталей, — это разрыхляющие МО.
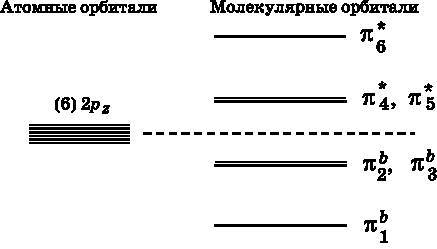
Рис. 18.4. Слева: бензол содержит шесть атомов углерода, каждый с 2pz-орбиталью. Они обладают одинаковой энергией, что обозначено шестью близко расположенными линиями. Справа: шесть pz-орбиталей объединяются и образуют шесть молекулярных
На рис. 18.5 изображены энергетические уровни связывающих и разрыхляющих орбиталей с размещенными на них шестью электронами, по одному от каждого атома углерода. Мы помещаем электроны на низший доступный в соответствии с принципом Паули энергетический уровень. Принцип Паули (см. главу 11) утверждает, что на одной орбитали могут находиться не более двух электронов и что они должны иметь противоположные спины (один ориентирован вверх, другой — вниз). Первые два электрона занимают МО с наименьшей энергией. Следующие две МО имеют одинаковую энергию, что изображено двумя близко расположенными линиями. Каждую из этих МО занимают два электрона. Эти три МО, заполненные шестью электронами, являются
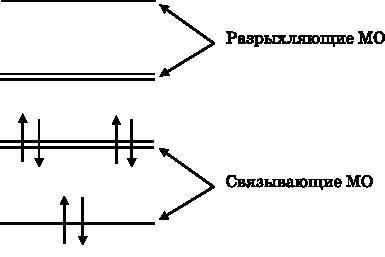
Рис. 18.5. Энергетические уровни молекулярных
Углерод-углеродная связь порядка 1,5
На рис. 18.5 видно, что шесть pz-электронов углерода занимают три
Углеродные кольца с делокализованными
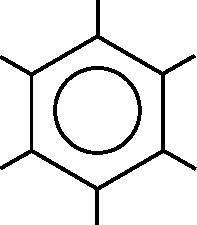
Рис. 18.6. Молекулярная диаграмма бензола. В каждой вершине находится атом углерода, а атомы водорода располагаются на свободных концах отрезков, отходящих от углерода. В виде окружности изображены делокализованные молекулярные
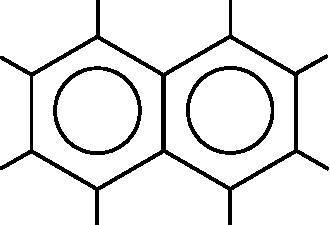
Рис. 18.7. Молекулярная диаграмма нафталина. Нафталин содержит десять атомов углерода и восемь атомов водорода. Окружности изображают делокализованные молекулярные
Бензольные делокализованные молекулярные пи-орбитали
Бензол, нафталин и другие подобные молекулы называют ароматическими. Обычно они имеют приятный аромат. Нафталин используется против моли и имеет характерный запах. Духи содержат более сложные ароматические молекулы, в которые входит множество бензолоподобных колец, а также другие химические группы вместо атомов водорода. Небольшие изменения в молекулярной структуре приводят к изменению аромата, и именно поэтому разные духи пахнут по-разному.
В главе 8 мы обсуждали задачу о частице в ящике. На рис. 8.4 и 8.6 изображены волновые функции и энергетические уровни частицы в ящике. Волновая функция, связанная с низшим энергетическим уровнем, не имеет узлов. На следующем энергетическом уровне волновая функция имеет один узел, на следующем — два узла и т.д. Узел — это место, где волновая функция обращается в нуль, то есть вероятность обнаружить электрон равна нулю. Частица в ящике — это одномерная задача. Узел является точкой. В главе 10 мы анализировали волновые функции и энергетические уровни атома водорода. На рис. 10.2 и 10.6 изображены волновые функции атома водорода для состояний 1s, 2s и 3s. Эти волновые функции трехмерные. Низшее энергетическое состояние (1s) не имеет узлов, следующее по энергии состояние (2s) имеет волновую функцию с одним узлом. Еще более высокое энергетическое состояние (3s) имеет два узла. Эти узлы представляют собой трехмерные поверхности, на которых вероятность обнаружения электрона равна нулю.