F – актин
↓
Актин – Миозин
↓
АДФ, Фн
↓
сократительный цикл
Рис. 33.2. Роль ионов кальция в мышечном сокращении
Биохимия мышечного утомления
Утомление – состояние организма, возникающее вследствие длительной мышечной нагрузки и характеризующееся временным снижением работоспособности.
Центральная роль в развитии утомления принадлежит нервной системе. В состоянии утомления в нервных клетках снижается концентрация АТФ, нарушается синтез ацетилхолина в синапсах и передача двигательных импульсов к мышце.
Биохимические изменения в работающей мышце при утомлении:
1. снижение содержания АТФ, креатинфосфата, гликогена;
2. снижение активности Са2+-актомиозиновой АТФазы, что приводит к уменьшению скорости расщепления АТФ в миофибриллах и к уменьшению мощности выполняемой работы;
3. снижение активности ферментов аэробного окисления субстратов и нарушение сопряжения реакций окисления с синтезом АТФ;
4. усиление гликолиза, сопровождающееся накоплением молочной кислоты и снижением рН крови (до 7,25 – 7,15);
5. закисление крови приводит к нарушению гомеостаза, появляются боли в мышцах, тошнота, головокружение;
6. развитие внутриклеточного метаболического ацидоза и ингибирование ключевых ферментов гликолиза.
Утомление является защитной реакцией организма, предохраняющей его от функционального истощения.
Глава 34. Биохимия соединительной ткани
Соединительная ткань составляет около половины от сухой массы тела.
Все разновидности соединительной ткани, несмотря на их морфологические различия, построены по общим принципам:
1. Содержит мало клеток в сравнении с другими тканями. В результате межклеточный матрикс занимает больше место, чем клетки и имеет сложный химический состав.
2. Основные компоненты межклеточного матрикса – структурные белки коллаген и эластин, гликозаминогликаны, протеогликаны, а также неколлагеновые структурные белки (фибронектин, ламинин, тенасцин, остеонектин и др.), которые образуют своеобразные волокнистые структуры.
Коллаген.
В межклеточном матриксе молекулы коллагена образуют полимеры, называемые фибриллами коллагена. Они обладают огромной прочностью и практически не растяжимы (они могут выдерживать нагрузку в 10 000 раз превышающую их собственный вес.
Необычные механические свойства коллагена связаны с их первичной и пространственной структурами. Молекулы коллагена состоят из трех полипептидных цепей, называемых a-цепями. Идентифицировано более 20 a-цепей, большинство из которых имеет в своем составе 1000 аминокислотных остатков, но цепи несколько отличаются аминокислотной последовательностью. В состав коллагенов могут входить три одинаковые или разные цепи.
Первичная структура a-цепей коллагена необычна, так как каждая третья аминокислота в полипептидной цепи представлена глицином, около 25% составляют пролин или 4-гидроксипролин, около 10% – аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан. В составе первичной структуры a-цепи коллагена содержится так же необычная аминокислота гидроксилизин.
Катаболизм коллагена. Как и любой белок, коллаген функционирует в организме определенное время. Его относят к медленно обменивающимся белкам, период его полураспада составляет около месяца. Разрушение коллагеновых волокон осуществляется ферментативно и с помощью активных форм кислорода.
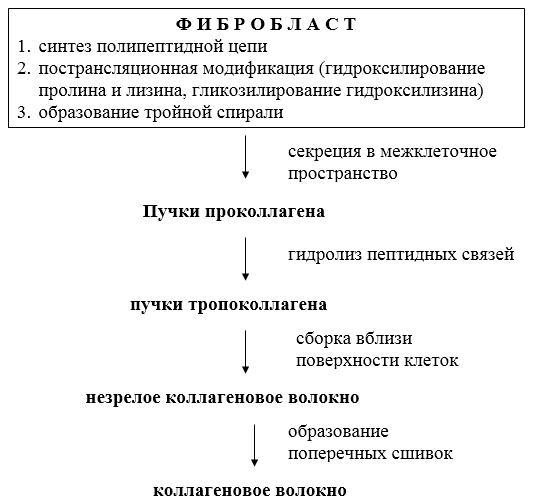
Рис. 34.1. Этапы формирования коллагенового волокна.
Нативный коллаген не гидролизуется обычными пептидогидролазами. Основной фермент его катаболизма – коллагеназа, которая расщепляет пептидные связи в определенных участках спирализованных областей коллагена. В норме она синтезируется клетками соединительной ткани, прежде всего фибробластами и макрофагами. Образующиеся фрагменты коллагена растворимы в воде, при температуре тела они спонтанно денатурируются и становятся доступными для действия других протеолитических ферментов.
Существует ряд заболеваний, связанных с нарушением структуры или синтеза коллагена. Они составляют целую группу заболеваний соединительной ткани, названных коллагенозами. Так как около 50% всех коллагеновых белков содержится в тканях скелета, около 40% - в коже и 10% – в строме внутренних оганов, клиническая картина этих заболеваний будет крайне полиморфной. При многих заболеваниях наблюдаются не только костно-суставная патология или изменения со стороны кожи, но и ярко выраженные висцеральные проявления (поражения кишечника, почек, легких, сердца). К наиболее распространенным и изученным коллагенозам относят несовершенный остеогенез, синдром Элерс-Данлоса, синдром Марфана, а так же цингу.
Эластин
В отличие от коллагена, образующего прочные фибриллы, эластин обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях легких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной. Но после снятия нагрузки они возвращаются к свернутой конформации.
Эластин содержит в своем составе около 800 аминокислотных остатков, средии которых преобладают аминокислоты с неполярными радикалами: глицин, валин, аланин. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина и полностью отсутствует гидроксилизин. Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи не формируют регулярные вторичную и третичную структуры, а принимают разные конфигурации. В соединительной ткани молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны множеством жестких поперечных сшивок в разветвленную сеть. В образовании этих сшивок участвуют остатки лизина двух, трех или четырех пептидных цепей. Структуры, образующиеся при этом, называются десмозинами.
Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности.
Следует отметить, что эластин синтезируется как растворимый мономер, который называется «тропоэластин». После образования поперечных сшивок эластин приобретает свою конечную форму, которая характеризуется нерастворимостью, высокой стабильностью и очень низкой скоростью обмена.
Протеогликаны и гликопротеины
Протеогликаны – высокомолекулярные соединения, состоящие из белка (5–10%) и гликозаминогликанов (90–95%). Они образуют основное вещество межклеточного матрикса.
Гликозаминогликаны – гетерополисахариды, состоящие из многократно повторяющихся дисахаридов, мономерами которых являются уроновые кислоты и гексозамины.. Раньше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах. Они связывают большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Белки протеогликанов называют коровыми или сердцевинными белками. Полисахаридные компоненты у разных протеогликанов разные.