В 1907 году стало ясно, что два элемента, получающиеся при радиоактивном распаде (торий и радиоактивный торий) обладают разными физическими, но абсолютно идентичными химическими свойствами. Чтобы разделить их, ставились различные химические опыты, но все безрезультатно. В течение нескольких последующих лет был открыт еще ряд таких неразделяемых химически элементов. Фредерик Содди, обосновавшийся к тому времени в Глазго, предположил: атомный вес — единственное, что отличает эти новые радиоактивные элементы от их известных “полных химических аналогов”67. Они напоминают близнецов, вес которых немного отличается.
В 1910 году Содди высказал предположение, что неразделимые химическими методами радиоактивные элементы (позднее он назвал их изотопами) — просто разные формы одного и того же элемента, и поэтому все они должны занимать одну и ту же клетку в периодической таблице68. Эта идея противоречила принятым правилам размещения элементов в периодической таблице: элементы располагались в порядке возрастания их атомного веса. Первым был водород, последним — уран. Но тот факт, что и радиоторий, и радиоактиний, и ионий, и уран X с точки зрения химии идентичны торию, убедительно свидетельствовал в пользу существования изотопов Содди69.
До разговоров с Хевеши Бор не проявлял интереса к модели атома Резерфорда. Но теперь у него возникла идея: различать атомы только по их физическим и химическим свойствам недостаточно, надо учитывать и различие ядер атомов. Не обращая внимания на неизбежность коллапса атома с ядром, Бор отнесся к модели Резерфорда с полной серьезностью и попытался согласовать наличие изотопов с использованием атомных весов для упорядочения периодической таблицы. “После этого, — скажет он позднее, — все встало на свои места”70.
Бор понял, что число электронов в атоме Резерфорда задается зарядом ядра. Поскольку атом нейтрален, то есть не обладает отличным от нуля зарядом, очевидно, что положительный заряд ядра должен компенсироваться суммарным отрицательным зарядом всех его электронов. Поэтому атом водорода в модели Резерфорда должен состоять из ядра с зарядом плюс один и одного электрона с зарядом минус один.
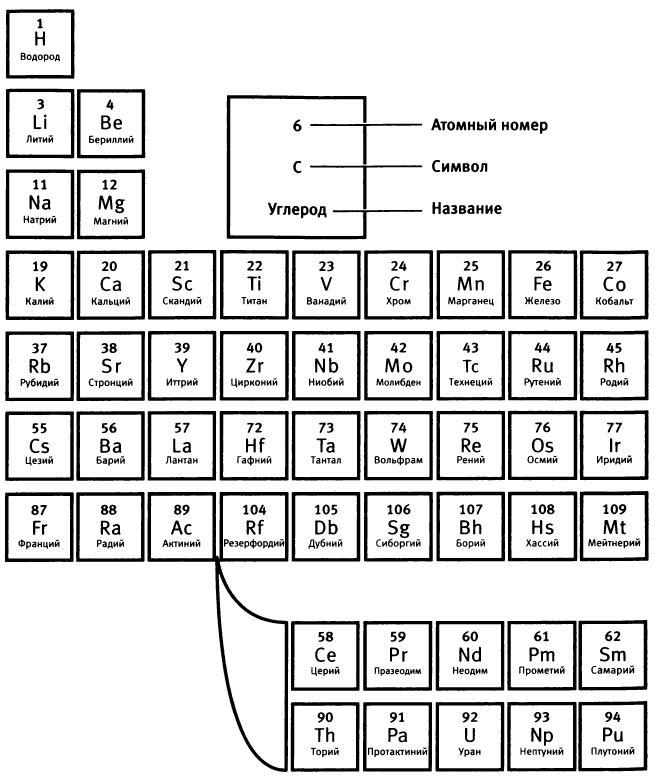
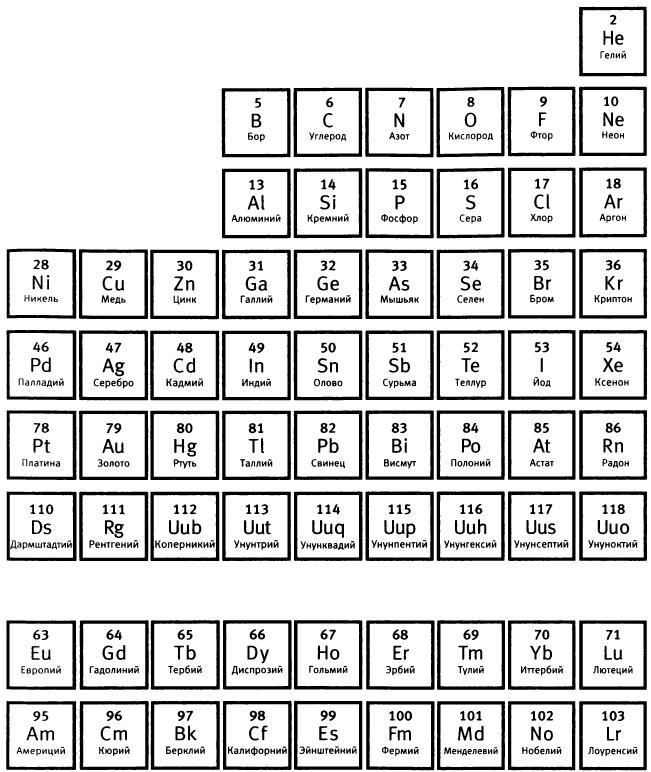
Рис. 5. Периодическая таблица химических элементов (Летом 2012 года Международный союз теоретической и прикладной химии утвердил названия элементов 114 и 116: флеровий (Н) и ливерморий (Lv). - Прuм. ред.)
Атом гелия, заряд ядра которого равен плюс двум, должен содержать два электрона. Увеличение заряда ядра при одновременном увеличении числа электронов позволяло выстроить по порядку элементы от водорода до самого тяжелого известного в то время элемента — урана (заряд ядра равен 92).
Бору было очевидно, что именно заряд ядра определяет положение атома в периодической таблице. Отсюда оставался один шаг до теории изотопов. Именно Бор, а не Содди, понял, что заряд ядра, а не атомный вес объединяет радиоактивные элементы, обладающие одинаковыми химическими, но различными физическими свойствами. Периодическая таблица может вместить и радиоактивные элементы — надо только расположить их в соответствии с зарядом их ядра.
Теперь Бор смог объяснить, почему Хевеши не удается разделить свинец и радий D. Если электроны определяют химические свойства, то любые два элемента с одинаковым числом и одинаковой конфигурацией электронов будут химически неразличимы. Так, свинец и радий D имеют один и тот же заряд ядра (82) и поэтому одно и то же число электронов (82), что делает идентичными их химические свойства. При этом свинец и радий D отличаются по своим физическим свойствам, поскольку различны массы их ядер. Масса ядра свинца примерно равна 207, радия D — 210. Отсюда Бор вывел, что радий D — это изотоп свинца и поэтому не может быть отделен от него при химических экспериментах. Позднее все изотопы стали называть так, как и элементы, изотопами которых они являются. Указывают только атомный вес изотопа: так, радий D — это свинец-210.
Бор ухватил суть: радиоактивность — явление, связанное с ядрами, а не с атомами. Это позволило ему объяснить на ядерном уровне процесс радиоактивного распада, когда один радиоактивный элемент превращается в другой с испусканием α-, β- или γ-излучения. Бор отдавал себе отчет в том, что если радиоактивность связана с ядерными процессами, то при превращении ядра урана с зарядом плюс 92 в уран X путем испускания α-частицы теряются две единицы положительного заряда и образуется ядро с зарядом плюс 90. Это новое ядро не может удержать все 92 электрона свинца, поэтому оно быстро теряет два из них, что приводит к появлению нового нейтрального атома. Каждый новый атом, образующийся в результате радиоактивного распада, чтобы остаться нейтральным, немедленно приобретает либо теряет электроны. Уран X с зарядом ядра плюс 90 является изотопом тория. Они оба, объяснял Бор, “обладают одним и тем же зарядом ядра и отличаются только массой и внутренней структурой ядер”71. Именно поэтому не удается разделить торий (атомный вес 232) и уран X, то есть торий-234.
Теория Бора описывала, что происходит на ядерном уровне при радиоактивном расщеплении элементов. Из нее, скажет Бор позднее, следовало, что “при радиоактивном распаде элемент, совершенно независимо от изменения его атомного веса, может сдвинуться со своего места в периодической таблице на две клетки назад или на одну клетку вперед. Это означает уменьшение или увеличение заряда ядра, сопровождающееся испусканием, соответственно, α- или β-лучей”72. Уран, распадающийся с испусканием альфа-частицы, превращается в торий-234 и переходит на две клетки назад в периодической таблице.
Бета-частицы, представляющие собой быстрые электроны, обладают отрицательным зарядом, равным минус единице. Если ядро испускает одну β-частицу, то его положительный заряд увеличивается на единицу. Это похоже на то, как если бы две частицы, одна заряженная положительно, а другая — отрицательно, мирно существовали в виде нейтральной пары, которая разрывается на части, испуская электрон и оставляя положительно заряженный осколок. Ядро нового атома, образующегося при β-распаде, обладает зарядом на единицу больше, чем распавшийся атом, и, следовательно, сдвигается в периодической таблице на одну клетку вперед.
Когда Бор решился рассказать обо всем этом Резерфорду, тот предостерег его и заметил, что опасно “экстраполировать достаточно скудные экспериментальные данные”73. Обескураженный холодным приемом, Бор попытался убедить Резерфорда, что такая теория “будет решающим доказательством справедливости его модели атома”74. Он потерпел фиаско. В какой-то степени это произошло из-за того, что Бор не сумел ясно изложить свои мысли. В это время Резерфорд писал книгу. Он был занят и не нашел времени, чтобы полностью осмыслить значение сделанного Бором. Резерфорд верил, что хотя альфа-частицы и испускаются ядрами, бета-частицы суть просто электроны, каким-то образом выталкиваемые из радиоактивного атома. Хотя Бор целых пять раз пытался переубедить Резерфорда, тот по-прежнему сомневался в логической последовательности его выводов75. Чувствуя, что Резерфорд “немного раздражен” и им самим, и его идеями, Бор решил оставить все, как есть76. Однако другие этого не допустили.
Очень скоро Фредерик Содди нащупал тот же “закон смещения”, что и Бор, однако он мог, в отличие от молодого датчанина, публиковать свои работы без согласия руководителя. Никто не был удивлен, что именно Содди может прорвать линию фронта. Но уж никто не мог предположить, что эксцентричный сорокадвухлетний голландский юрист станет автором такой принципиально важной идеи. В июле 1911 года Антониус Иоханнес ван ден Брук опубликовал в журнале “Нейчур” небольшую статью. Он предположил, что заряд ядра элемента определяется не его атомным весом, а местом в периодической таблице, его атомным номером. Хотя ван ден Брук исходил из модели атома Резерфорда, его выводы основывались на оказавшихся неверными предположениях. Например, он считал, что заряд ядра элемента равен половине его атомного веса. Резерфорд был заметно раздражен тем, что юрист опубликовал “смеха ради кучу догадок безо всякого научного обоснования”77.