В процессе диссоциативной рекомбинации (10) энергия рекомбинации тоже сначала идет на возбуждение. Но образующаяся молекула нестабильна: она не может удержать полученный запас энергии и распадается на составляющие ее атомы, один из которых в свою очередь может быть возбужден.
Такой путь освобождения энергии, выделяющейся при рекомбинации, более всего удобен природе - константа скорости диссоциативной рекомбинации весьма высока. Если для процесса радиативной рекомбинации (6), как мы видели, константа скорости равна 10-12 см3×с-1, то для процессов диссоциативной рекомбинации основных ионосферных ионов она составляет 10-6-10-7 см3×с-1. Разница в миллион раз и определяет ту важную роль, которую процесс диссоциативной рекомбинации играет в ионосфере как главный рекомбинационный процесс выше 100 км.
Что же мы знаем и чего не знаем сейчас о конкретных процессах диссоциативной рекомбинации?
В ионосфере нас интересует главным образом диссоциативная рекомбинация трех основных молекулярных ионов NO+, О2+ и N2+:
О рекомбинации сложных ионов-связок, наблюдаемых в области D, мы поговорим в одной из следующих глав. Для ионов N2+, О2+ и NO+ было проведено много лабораторных измерений. Трудности таких измерений и забавные случаи, которые при этом возникали, описаны в книге "Химия, атмосфера и космос". К настоящему времени эти трудности преодолены - мы имеем надежные значения констант диссоциативной рекомбинации для наших ионов (обозначим их соответственно αN0+, αО2+ и αN2+) при комнатной температуре (около 300 К):
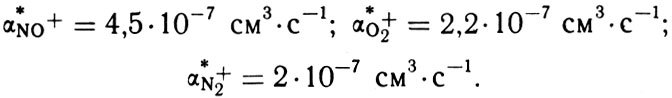
Однако температура 300 К не характерна для верхней атмосферы. Для интересующих нас высот более характерны температуры 1000 К и выше. Значит, нужно еще знать, как меняются величины α* с температурой. Но тогда возникает следующий вопрос: с какой именно температурой? Ведь в реакции участвуют ион и электрон, а температура ионов и электронов в ионосфере может быть различной. А может, вообще, величины α* зависят от температуры основной массы частиц среды, т. е. от температуры нейтралов?
Полностью этот вопрос не решен и по сей день. При лабораторных измерениях, которые, собственно, и питают нас сведениями о скоростях диссоциативной рекомбинации для различных ионов, получают несколько разную картину изменения α* в зависимости от того, меняют ли в эксперименте только электронную температуру Те при неизменных ионной температуре Ти и температуре нейтралов Тн или увеличивают Те и Ти одновременно. Принято все же считать (и это является основой всех аэрономических расчетов), что в первую очередь величины α* зависят от температуры электронов. Для ионов NO+ и О2+ принимается обратно пропорциональная зависимость α* от Те, а для N2+ зависимость оказалась настолько слабой, что ею часто пренебрегают. Таким образом, в основной части ионосферы мы имеем три процесса диссоциативной рекомбинации (11) - (13) с константами скорости:
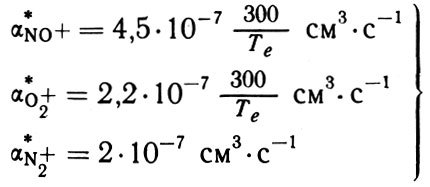
Казалось бы, выражения (15) дают нам исчерпывающий ответ на все вопросы, связанные с диссоциативной рекомбинацией молекулярных ионов в ионосфере. На любой высоте, в любых условиях, зная электронную температуру, можно вычислить α* для любого из ионов. И действительно, знание величин α* в виде (15) считалось бы вполне достаточным 10 лет назад. Но, увы, не сегодня - ведь аэрономия не стоит на месте.
На два вопроса мы не получаем ответа, имея выражения (15). Первый - что будет, если ионы находятся в возбужденном состоянии? Все измерения в лаборатории проводятся для невозбужденных ионов. А в ионосфере, как мы теперь понимаем, часть ионов может образовываться с запасом внутренней энергии - возбуждением. Как это отразится на эффективности диссоциативной рекомбинации, мы пока не знаем. Есть лишь общие соображения о том, что величины α* для возбужденных ионов должны быть ниже и могут составлять даже 10-8 см3×с-1. Иначе говоря, возбужденные ионы должны быть более долгоживущими, чем обычные. Если это так, то даже небольшая доля возбужденных ионов (скажем, 10%) может приводить к заметному, в 2 раза, увеличению равновесной концентрации ионов. А это очень существенно.
Второй вопрос тоже связан с возбуждением. Но уже продуктов реакции (11) - (13)-атомов кислорода и азота. В большинстве случаев один или оба продукта диссоциативной рекомбинации должны "быть возбуждены. Но в какое состояние? (Скажем, атом кислорода будет в состоянии 1D или 1S?) И какой из атомов? Пойдет ли реакция диссоциативной рекомбинации NО+ по пути (11) с образованием возбужденного атома азота или по пути NO++е→N + O* С образованием возбужденного атома кислорода?
Мы не будем сейчас говорить о том, почему важно знать ответы на эти вопросы. Отметим лишь, резюмируя положение дел с диссоциативной рекомбинацией, что основными сведениями об этом процессе, необходимыми для анализа всего цикла процессов ионизация - рекомбинация, мы располагаем, ну а отсутствие данных о возбуждении продуктов - атомов азота и кислорода - порождает свои проблемы в другой области: в физике малых составляющих и возбужденных частиц, о которых мы поговорим позже.
Выражение "ионно-молекулярные реакции" стали употреблять в аэрономии около 10 лет назад. До того использовали термины вроде "перезарядка", "перенос зарядов", которые и сейчас изредка встречаются в литературе.
Что же стоит за выражением "ионно-молекулярные реакции"? Эти реакции объединяют несколько типов процессов. Не вдаваясь в детали химической кинетики, приведем характерные примеры в виде тех реакций, которые понадобятся нам в дальнейшем:
Несмотря на заметные различия, у этих реакций много общих черт. В каждой реакции участвуют заряженная (положительный ион) и нейтральная частицы и получаются заряженная и нейтральная частицы. Значит, ни образования, ни исчезновения зарядов не происходит. Происходит их перераспределение. В этом отличие ионно-молекулярных реакций от процессов ионизации, где заряженные частицы образуются, и от рекомбинационных процессов, где они гибнут.
Вторая важная особенность ионно-молекулярных реакций состоит в том, что слева всегда стоит ион с большим потенциалом ионизации, чем справа. Это необходимо для того, чтобы реакция не требовала дополнительной энергии, т. е. была, как говорят, экзотермической. Если же это условие нарушить, то мы получим реакцию, которая для своего протекания требует подпитки энергии извне, т. е. является эндотермической. Такие процессы, как правило, идут медленно и большой роли в аэрономии не играют. Требование экзотермичности приводит к тому, что в аэрономических ионно-молекулярных реакциях чаще всего образуются ионы N0+ и O2+, редко - ионы О+ и никогда не образуются ионы N2+.
Стоит обратить внимание еще на одну характерную деталь. Из четырех процессов, которые мы выбрали для примера, два содержат в правой части атомы азота, а в левой - молекулы N2. Значит, ионно-молекулярные реакции кроме перераспределения ионов могут приводить и к диссоциации молекул (скажем, N2) на атомы. Для кислорода это почти несущественно, а вот для образования атомного азота... Но об этом мы поговорим в одной из следующих глав.
Нас, как всегда, в первую очередь интересует эффективность данного типа процессов, т. е. константы скорости ионно-молекулярных реакций. Нужно отметить, что разброс значений у для различных ионосферных реакций гораздо больше, чем разброс значений α*. Как мы только что видели, для константы диссоциативной рекомбинации при 300 К разница между быстро рекомбинирующим ионом окиси азота и медленно рекомбинирующим ионом N^ относительно невелика - два с небольшим раза. А в случае ионно-молекулярных реакций диапазон у при комнатной температуре достигает двух порядков величины - от 10-12 см3×с-1 до 10-10cм3×c-1.