У вас может возникнуть и такая проблема: после охлаждения горячего раствора вы не найдете среди выпавших кристаллов достаточно большого и хорошего, чтобы его можно было подвесить на нитке. В таком случае просто положите кристаллик побольше на дно кристаллизатора и залейте его насыщенным запасным раствором. Раз в день поворачивайте кристаллик с боку на бок, и через некоторое время он подрастет — тогда его без труда можно будет подвесить.
Кристалл, подвешенный на нитке, имеет то преимущество, что может свободно расти во все стороны, поэтому со временем он примет правильную форму, свойственную данному веществу. Для алюмокалиевых квасцов эта форма — октаэдр. Даже если сначала кристалл имел неправильную форму, он рано или поздно все равно превратится в октаэдр.
Более того, если кристалл с правильной формой специально испортить, например, отбить у него вершины, повредить ребра и грани, то при дальнейшем росте в насыщенном растворе такой кристалл начнет самостоятельно «залечивать» свои повреждения! Ученые проводили такие опыты: правильный красивый кристалл, например октаэдр, обточили так, что получился шар. И все равно из него в растворе снова образовался кристалл такой формы, которая характерна именно для этого вещества. Только учтите, что если «покалеченный» кристалл слишком большой, у вас может просто не хватить запасного раствора для восстановления его первоначальной формы — ведь во время «лечения» кристалл продолжает непрерывно расти. Поэтому понаблюдайте, как это происходит с маленьким затравочным кристаллом, который вы подвесили на ниточке: вы увидите, как постепенно «нужные» грани будут увеличиваться, вытесняя «неправильные».
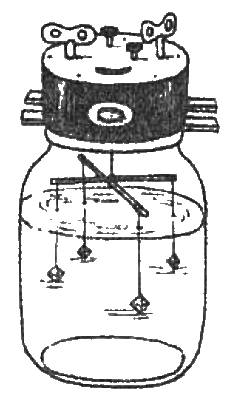
Итак, кристалл начал расти. Во избежание неправильного роста, постарайтесь, чтобы температура кристаллизатора не менялась со временем, чтобы растущий кристалл был всегда покрыт слоем насыщенного раствора, который надо периодически подливать, и чтобы стенки и дно кристаллизатора, нить и сам растущий кристалл не обрастали новыми маленькими кристалликами. Для этого время от времени проводите чистку кристаллизатора: сливайте на время раствор из него и удаляйте наросшие кристаллики, перенося их в запасной раствор. Лучше всего кристалл растет, когда он со всех сторон окружен раствором. В лабораториях для этого раствор перемешивают, а вот ребята из химического кружка при криворожской станции юных техников приспособили для той же цели… старый будильник (рис. 5.3).
Размер кристалла, который можно вырастить таким образом, теоретически безграничен. Известны случаи, когда энтузиасты выращивали кристаллы такой величины, что могли их поднять только с помощью товарищей. Вы же ограничены количеством имеющегося вещества. Важен также и размер кристаллизатора: лучше, чтобы в конце опыта, когда запасного раствора останется мало, кристалл оказался бы как можно ближе к стенкам кристаллизатора — тогда запас вещества будет использован максимально эффективно. Этому же способствуют прямые стенки кристаллизатора — без сужения вверху. И еще: большой кристалл рано или поздно оборвет нитку. Ничего страшного — он будет расти на дне кристаллизатора, только не забывайте при этом раз в несколько дней поворачивать его на другой бок, чтобы все грани росли равномерно. Готовый кристалл покройте бесцветным лаком, чтобы предохранить его от выветривания. Точно так же поступают и при выращивании кристалла медного купороса. Он, в отличие от кристалла квасцов, несимметричен, но тоже очень красивый. Не забывайте после работы с медным купоросом тщательно мыть руки!
Вы уже знаете, что в США температуру принято измерять в градусах Фаренгейта. В поисках постоянных точек для придуманной им температурной шкалы Фаренгейт наблюдал замерзание и плавление различных веществ. Однажды, проводя опыты с чистой водой, Фаренгейт обнаружил удивительное явление: вода в закрытой посуде не замерзла в течение ночи на сильном морозе! Но стоило ему открыть банку, как вода начала стремительно замерзать: возникло множество игольчатых, быстро растущих кристаллов льда. Кристаллизация происходила также и при резком встряхивании банки. Повторив опыты с водой и различными растворами, Фаренгейт убедился, что это не такое уж редкое явление. Оно было названо переохлаждением.
В начале XIX века петербургский академик Иоганн Тобиас (в России его имя переиначили на Товий Егорович) Ловии (1757–1804) наблюдал похожее явление — пересыщение раствора. Оказалось, что в чистом закрытом сосуде горячий насыщенный раствор можно охладить, а кристаллы из него не выпадут. Но если в такой пересыщенный раствор внести маленький кристаллик, в нем начнется массовый рост больших кристаллов. Ловиц так образно описал это явление: «Мне представилось, будто находящиеся в растворе соляные частицы борются за преимущество первой выделиться из воды и что та частица, которой это удалось, подобно полководцу, подает сигнал другим следовать за собой».
Раствор, который содержит в определенном количестве растворителя больше растворенного вещества, чем это «положено» при данной температуре, называется пересыщенным раствором. Пересыщенный раствор невозможно получить даже очень длительным перемешиванием кристаллов с растворителем, он может образоваться только путем охлаждения горячего насыщенного раствора. Поэтому такие растворы называют также переохлажденными. В них что-то мешает началу кристаллизации, например, раствор слишком вязкий или для роста кристаллов требуются большие зародыши, которых в растворе нет. Но если в переохлажденный раствор внести готовый зародыш, например, маленький кристаллик того же вещества, то начнется бурная кристаллизация. Интересно, что быструю кристаллизацию вызывает кристалл только того вещества, которое подвергается кристаллизации, а к постороннему веществу раствор совершенно безразличен.
Этот красивый опыт мы проведем с тиосульфатом натрия. Насыпьте немного данного вещества в пробирку (примерно до середины) и плотно закройте ее кусочком ваты. Осторожно опустите нижнюю часть пробирки в горячую, но не кипящую воду; при этом уровень горячей воды должен быть выше уровня кристаллов в пробирке. Когда содержимое пробирки нагреется примерно до +56 °C, кристаллы «расплавятся». В действительности это не плавление, а растворение тиосульфата натрия в «собствен ной» кристаллизационной воде. С повышением температуры растворимость тиосульфата натрия, как и большинства других веществ, увеличивается, и при +56 °C его собственной кристаллизационной воды оказывается достаточно, чтобы растворить в ней весь имеющийся тиосульфат. Если кристаллы тиосульфата частично выветрились и имеют белый налет, добавьте к ним перед нагреванием несколько капель воды. Медленно и осторожно, избегая резких толчков, поставьте пробирку в стакан или баночку для охлаждения. Если пробирка была чистая, то при ее охлаждении кристаллы не выпадут.
«Поможем» пересыщенному раствору тиосульфата перейти в нормальное состояние (напомним, что «нормальным» при комнатной температуре состоянием для нашего вещества является твердое). Для этого прикрепите небольшой кристаллик тиосульфата к концу стеклянной палочки с помощью кусочка пластилина. Осторожно откройте пробирку и внесите в нее палочку так, чтобы кристаллик коснулся поверхности раствора. Произойдет настоящее чудо: от кристаллика побежит фронт кристаллизации, который быстро дойдет до дна пробирки (рис. 5.4). Так что уже через несколько секунд жидкость в пробирке полностью «затвердеет». Вы можете перевернуть ее — из пробирки не выльется ни одной капли! Твердый тиосульфат можно снова расплавить в горячей воде и повторить все заново. Понаблюдайте внимательно, как растут кристаллы в пересыщенном растворе — зрелище очень красивое. Попробуйте поставить пробирку с переохлажаенным раствором в ледяную воду, а потом внести затравку: кристаллы будут расти медленнее, но более крупными.