Действительно, что произойдет при понижении температуры? Реальный газ в конце концов превратится в жидкость, а при еще большем снижении затвердеет. Молекулы газа соберутся в маленький объем. Но чему будет равен этот объем для нашего термометра, заполненного идеальным газом? Его молекулы не взаимодействуют между собой и не имеют собственного объема. Значит, понижение температуры приведет идеальный газ к нулевому объему. Приблизиться практически сколь угодно близко к поведению, характерному для идеального газа, в данном случае к нулевому значению объема, вполне возможно. Для этого газовый термометр надо заполнять все более и более разреженным газом. Поэтому мы не погрешим против истины, считая предельно малый объем газа равным нулю.
Согласно нашей формуле объему, равному нулю, соответствует самая низкая возможная температура. Эта температура и называется абсолютным нулем температуры.
Для того чтобы определить положение абсолютного нуля в шкале Цельсия, в выведенную формулу температуры надо подставить значение объема, равное нулю, V= 0. Таким образом, температура абсолютного нуля равна – ( V 0·100)/( V 100− V 0).
Оказывается, эта замечательная точка соответствует температуре примерно −273° (точнее −273,15°).
Итак, нет температур ниже абсолютного нуля; ведь они соответствуют отрицательным объемам газа. Говорить о более низких температурах бессмысленно. Получить температуры ниже абсолютного нуля так же невозможно, как изготовить проволоку с диаметром меньше нуля.
При абсолютном нуле тело нельзя охладить, т.е. нельзя отнять у него энергию. Иными словами, при абсолютном нуле тела и частицы, из которых они построены, обладают наименьшей возможной энергией. Это означает, что при абсолютном нуле кинетическая энергия равна нулю, а потенциальная имеет наименьшее возможное значение.
Поскольку абсолютный нуль есть самая низкая температура, то естественно, что в физике, особенно в тех ее разделах, где фигурируют низкие температуры, пользуются абсолютной шкалой температур, в которой отсчет ведется от абсолютного нуля. Ясно, что T абс= ( t+ 273)°C. Комнатная температура в абсолютной шкале лежит около 300°. Абсолютную шкалу температур называют также шкалой Кельвина – по имени известного английского ученого XIX века, и вместо обозначения Т абсупотребляют обозначение TK.
Формула газового термометра, определяющая температуру T, может быть записана для абсолютной температуры в виде

Пользуясь равенством 100 V 0/( V 100− V 0) = 273, приходим к простому результату:
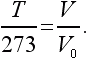
Таким образом, абсолютная температура просто пропорциональна объему идеального газа.
Точные измерения температуры требуют от физика всевозможных ухищрений. В довольно широком интервале температур ртутные, спиртовые (для Арктики) и другие термометры градуируются по газовому термометру. Однако и он непригоден при температурах, весьма близких к абсолютному нулю (ниже 0,7 K), когда все газы сжижаются, а также при температурах выше 600 °C, когда газы проникают через стекло. Для высоких и очень низких температур пользуются иными принципами измерения температур.
Что же касается практических способов измерения температуры, то их множество. Большое значение имеют приборы, основанные на электрических явлениях. Сейчас важно запомнить лишь одно – при любых измерениях температуры мы должны быть уверены, что измеряемая величина вполне совпадает с тем, что дало бы измерение расширения разреженного газа.
Высокие температуры возникают в печах и горелках. В кондитерских печах температура достигает 220–280 °C. Более высокие температуры применяются в металлургии – 900–1000° дают закалочные печи, 1400–1500° – кузнечные. В сталеплавильных печах температура достигает 2000°.
Рекордно высокие печные температуры получают с помощью электрической дуги (около 5000°). Пламя дуги позволяет «расправиться» с самыми тугоплавкими металлами.
А какова температура пламени газовой горелки? Температура внутреннего голубоватого конуса пламени всего лишь 300°. Во внешнем конусе температура доходит до 1800°.
Несравненно более высокие температуры возникают при взрыве атомной бомбы. По косвенным оценкам, температура в центре взрыва достигает многих миллионов градусов.
В самое последнее время предприняты попытки получить такие сверхвысокие температуры в специальных лабораторных установках (Огра, Зета), изготовляемых у нас и за рубежом. На кратчайшее мгновение удавалось достигнуть температур до двух миллионов градусов.
Сверхвысокие температуры существуют и в природе, но не на Земле, а на других телах Вселенной. В центрах звезд, в частности Солнца, температура достигает десятков миллионов градусов.
Поверхностные же участки звезд имеют значительно более низкую температуру, не превышающую 20 000°. Поверхность Солнца нагрета до 6000°.
Теория идеального газа
Свойства идеального газа, давшего нам определение температуры, очень просты. При постоянной температуре действует закон Бойля – Мариотта: произведение pVпри изменениях объема или давления остается неизменным. При неизменном давлении сохраняется частное V/ T, как бы ни менялись объем или температура. Эти два закона легко объединить. Ясно, что выражение рV/ Тостается тем же, как при постоянной температуре, но изменяющихся Vи p, так и при постоянном давлении, но изменяющихся Vи T. Выражение pV/ Tостается постоянным при изменении не только любой пары, но и одновременно всех трех величин – р, Vи T. Закон ( pV)/ T= const, как говорят, определяет уравнение состояния идеального газа.
Идеальный газ выбран в качестве термометра потому, что только его свойства связаны с одним лишь движением (но не с взаимодействием) молекул.
Каков же характер связи между движением молекул и температурой? Для ответа на этот вопрос надо найти связь между давлением газа и движением в нем молекул.
В сферическом сосуде радиуса Rзаключено Nмолекул газа (рис. 95). Последим за какой-либо молекулой, например той, что движется в данный момент слева направо вдоль хорды длиной l. На столкновения молекул обращать внимания не будем: такие встречи не сказываются на давлении. Долетев до границы сосуда, молекула ударится о стенку и с той же скоростью (удар упругий) понесется уже в другом направлении. В идеале такое путешествие по сосуду могло бы продолжаться вечно. Если v– скорость молекулы, то каждый удар будет происходить через l/ vсекунд, т.е. в секунду каждая молекула ударится v/ lраз. Непрерывная дробь ударов Nмолекул сливается в единую силу давления.
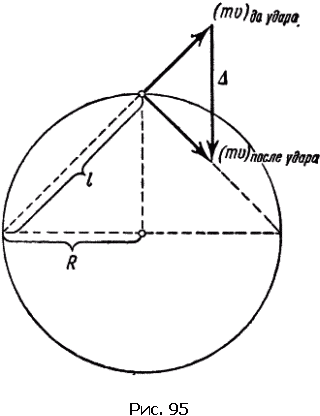
По закону Ньютона сила равна изменению импульса в единицу времени. Обозначим изменение импульса при каждом ударе через Δ. Это изменение происходит v/ lраз в секунду. Значит, вклад в силу со стороны одной молекулы будет (Δ/ l)· v.
На рис. 95 построены векторы импульсов до и после удара, а также вектор приращения импульса Δ. Из подобия возникших при построении треугольников следует: Δ/ l= mv/ R. Вклад в силу со стороны одной молекулы примет вид: