Единицы, особенно удобные для описания атомного мира, называются ангстремами (правда, фамилия шведского ученого, именем которого названы эти единицы, правильно читается Онгстрем; для напоминания об этом над буквой А ставят кружок).
1 Å = 10 −8см,
т.е. одной стомиллионной доле сантиметра.
Расстояния между атомами молекул лежат в пределах от 1 до 4 ангстрем. Написанное выше равновесное расстояние для кислорода равно 1,2 Å.
Межатомные расстояния, как вы видите, очень малы. Если опоясать земной шар веревкой у экватора, то длина «пояса» во столько же раз будет больше ширины вашей ладони, во сколько раз ширина ладони больше расстояния между атомами молекулы.
Для измерения энергии связи пользуются обычно калориями, но относят их не к одной молекуле, что дало бы, разумеется, ничтожную цифру, а к грамм-молекуле, т.е. к числу граммов, равному относительному молекулярному весу.
Ясно, что энергия связи на грамм-молекулу, если ее поделить на число Авогадро N= 6,023·10 23, даст энергию связи одной молекулы.
Энергия связи атомов в молекуле, как и межатомные расстояния, колеблется в незначительных пределах.
Для того же кислорода энергия связи равна 116 000 калорий на грамм-молекулу, для водорода – 103 000 калорий и т.д.
Мы уже говорили, что атомы в молекулах располагаются вполне определенным образом одни по отношению к другим, образуя в сложных случаях весьма замысловатые постройки.
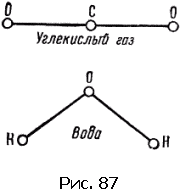
Приведем несколько простых примеров. В молекуле СO 2(углекислый газ) все три атома расположены в ряд – атом углерода посередине. Молекула воды Н 2O имеет уголковую форму, вершиной угла (он равен 105°) является атом кислорода.
В молекуле аммиака NH 3атом азота находится в вершине трехгранной пирамиды; в молекуле метана СН 4атом углерода находится в центре четырехгранной фигуры с равными сторонами, которая называется тетраэдром.
Атомы углерода бензола С 6Н 6образуют правильный шестиугольник. Связи атомов углерода с водородом идут от всех вершин шестиугольника. Все атомы расположены в одной плоскости.
Схемы расположения центров атомов этих молекул показаны на рис. 87 и 88. Линии символизируют связи.

Прошла химическая реакция; были молекулы одного сорта, образовались другие. Одни связи порваны; другие созданы вновь. Для разрыва связей между атомами – вспомните рисунок – нужно затратить такую же работу, как при выкатывании шара из ямы. Напротив, при образовании новых связей энергия выделяется – шар скатывается в яму.
Что больше, работа разрыва или работа созидания? В природе мы сталкиваемся с реакциями обоих типов.
Излишек энергии называется тепловым эффектом, или короче – теплотой превращения (реакции). Тепловые эффекты реакций – это большей частью величины порядка десятков тысяч калорий при расчете на моль. Очень часто тепловой эффект включают в качестве слагаемого в формулу реакции.
Например, реакция сгорания углерода в виде графита, т.е. соединения его с кислородом, пишется так:
С + О 2= СO 2+ 94 250 кал.
Это значит, что при соединении С с O 2выделяется энергия 94 250 калорий.
Сумма внутренних энергий грамм-атома углерода в графите и грамм-молекулы кислорода равняется внутренней энергии грамм-молекулы углекислого газа плюс 94 250 калорий.
Таким образом, подобные записи имеют ясный смысл алгебраических равенств, записанных для величин внутренней энергии.
С помощью таких уравнений можно найти тепловые эффекты превращений, для которых не годятся по тем или иным причинам прямые способы измерения. Вот пример: если бы углерод (графит) соединить с водородом, то образовался бы газ ацетилен:
2С + Н 2= С 2Н 2.
Реакция не идет таким путем. Тем не менее можно найти ее тепловой эффект. Запишем три известные реакции –
окисление углерода:
2С + 2О 2= 2СО 2+ 188 000,
окисление водорода:
Н 2+ (1/2)О 2= Н 2О + 68 000,
окисление ацетилена:
С 2Н 2+ (5/2)O 2= 2СО 2+ Н 2О + 312 000.
Все эти равенства можно рассматривать как уравнения для энергий связи молекул. Если так, то ими можно оперировать как с алгебраическими равенствами. Вычитая из нижнего два верхних, получим:
2С + H 2= С 2Н 2− 56 000.
Значит, интересующее нас превращение сопровождается поглощением 56 000 калорий на одну грамм-молекулу.
Взаимодействие молекул
Молекулы взаимно притягиваются, в этом невозможно сомневаться. Если бы в какое-то мгновение молекулы перестали притягиваться друг к другу, все жидкие и твердые тела распались бы на молекулы.
Молекулы взаимно отталкиваются, и это несомненно, так как иначе жидкости и твердые тела сжимались бы с необыкновенной легкостью.
Между молекулами действуют силы, во многом похожие на силы между атомами, о которых говорилось выше. Кривая потенциальной энергии, которую мы только что рисовали для атомов, правильно передает основные черты взаимодействия молекул. Однако между этими взаимодействиями имеются и существенные различия.
Сравним, например, равновесное расстояние между атомами кислорода, образующими молекулу, и атомами кислорода двух соседних молекул, притянувшихся в затвердевшем кислороде до равновесного положения. Различие будет очень заметным: атомы кислорода, образующие молекулу, устанавливаются на расстоянии 1,2 Å, атомы кислорода разных молекул подходят друг к другу на 2,9 Å.
Подобные результаты получаются и для других атомов. Атомы чужих молекул устанавливаются дальше один от другого, чем атомы одной молекулы. Поэтому молекулы легче оторвать одну от другой, чем атомы от молекулы, причем различия в энергиях много больше разницы в расстояниях. Если энергия, необходимая для разрыва связи между атомами кислорода, образующими молекулу, составляет около 100 ккал/моль, то энергия на растаскивание молекул кислорода меньше 2 ккал/моль.
Значит, на кривой потенциальной энергии молекул «яма» лежит дальше от вертикальной оси и, кроме того, «яма» гораздо менее глубока.
Однако этим не исчерпывается различие взаимодействия атомов, образующих молекулу, и взаимодействия молекул.
Химики показали, что атомы сцепляются в молекулу с вполне определенным числом других атомов. Если два атома водорода образовали молекулу, то третий атом уже не присоединится к ним для этой цели. Атом кислорода в воде соединен с двумя атомами водорода и присоединить к ним еще один невозможно.
Ничего подобного мы не находим в межмолекулярном взаимодействии. Притянув к себе одного соседа, молекула ни в какой степени не теряет своей «притягательной силы». Подход соседей будет происходить до тех пор, пока хватит места.
Что значит «хватит места»? Разве молекулы – это что-то вроде яблок или яиц? Конечно, в некотором смысле такое сравнение оправдано: молекулы – физические тела, обладающие определенными «размерами» и «формой». Равновесное расстояние между молекулами и есть не что иное, как «размеры» молекул.
Как выглядит тепловое движение
Взаимодействие между молекулами может иметь большее или меньшее значение в «жизни» молекул.
Три состояния вещества – газообразное, жидкое и твердое – различаются одно от другого той ролью, которую в них играет взаимодействие молекул.
Слово «газ» придумано учеными. Оно произведено от греческого слова «хаос» – беспорядок.
И действительно, газообразное состояние вещества является примером существующего в природе полного, совершенного беспорядка во взаимном расположении и движении частиц. Нет такого микроскопа, который позволил бы увидеть движение газовых молекул, но, несмотря на это, физики могут достаточно детально описать жизнь этого невидимого мира.