Диазометод получения фторароматических соединений основан на образовании борфторида выделяют в твёрдом при нагревании:
Замена кислородсодержащих группировок в различных органических соединениях на фтор при помощи SF4 (например, в спиртах, альдегидах, кетонах, кислотах):
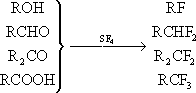
(R — органический остаток).
Присоединение безводного фтористого водорода к олефинам, галогенолефинам, окисям, изоцианатам, циклопарафинам и др., например:

Сопряжённое присоединение фтора и др. атомов или групп к соединениям, содержащим кратные связи, легко происходит в избытке безводного HF, например фторнитрование:

Методы получения фторолефинов. Дегалогенирование вицинальных дигалогенполифторалканов металлами (Zn, Mg и др.), например:
CF2 Cl — CF2 Cl + Zn ® CF2 = CF2 + ZnCl2 .
Пиролиз политетрафторэтилена, приводящий к образованию перфторпропилена и перфторизобутилена наряду с тетрафторэтиленом, перфторбутиленом, фторциклобутаном и др.:
[—CF2 —] n ® CF3 F = CF2 + (CF3 )2 C = CF2 + CF2 = CF2 + CF3 CF2 CF = CF2 и др.
В промышленности этим способом (а также пиролизом тетрафторэтилена) получают перфторпропилен — важный мономер для производства фторкаучуков.
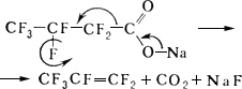
Пиролиз солей j-карбоновых кислот, например:
Фторированные спирты получают обычными методами синтеза спиртов , например восстановлением эфиров j-карбоновых кислот, фторированных альдегидов и кетонов. Важный промышленный способ их получения — теломеризация тетрафторэтилена метанолом:
n CF2 = CF2 + CH3 OH ® Н [—CF2CF2—] n СН2 ОН.
Свойства. Физические свойства. Низшие фторуглероды парафинового ряда (общая формула Cn F2n +2 ) — газы, начиная с C5 — жидкости, высшие — твёрдые воскообразные соединения. Только первые четыре представителя этого ряда кипят несколько выше соответствующих углеводородных аналогов, все остальные — ниже.
При замещении одного атома водорода в молекуле углеводорода на F температура кипения повышается, но меньше, чем при замене его на хлор. При полной замене атомов водорода на фтор у любых производных углеводородов температуры кипения очень сильно понижаются (см. табл.).
Сравнение температур кипения некоторых соединений
| Формула | tкип | Формула | tкип |
| 3 | +78 | 3 | -64 |
| 32 | +102 | 32 | -31 |
| 24 | +265 | 2 4 | +63 |
| 32 | +19 | 322 | -34.3 |
| 33 | +56 | 33 | +29 |
| +35 | -28 |
Фторуглероды — хорошие диэлектрики (удельное электрическое сопротивление около 1014 ом (см ; диэлектрическая проницаемость их значительно выше, чем у парафинов. Скорость распространения ультразвука во фторуглеродах необычайно низка (менее 800 м/сек ).
Химические свойства наиболее важных типов Ф. с. Фторуглероды парафинового и алициклических рядов характеризуются необычайно высокими химической инертностью и термостойкостью. Для них известно небольшое число реакций, осуществляемых лишь при высоких температурах. Так, пиролиз перфторэтана начинается около 1000°C, перфторгептана — около 800°C. Фторуглероды не реагируют в обычных условиях и при умеренном нагревании с концентрированными кислотами, сильными окислителями, металлами, щелочами и др.; реакция с металлическим натрием и перекисью натрия начинается при 400°C; Zn, Al, Fe и Sn в этих условиях реагируют очень медленно; Cu, Ag, Hg и некоторые др. в реакцию не вступают.
Перфторбензол и некоторые др. перфторароматические соединения легко взаимодействуют с нуклеофильными реагентами, например с аммиаком, аминами, алкоголятами, сульфидом натрия и др. При этом после замены одного атома фтора замещается второй, находящийся в пара- положении к первому:
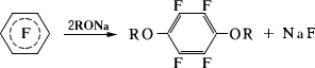
Пентафторхлорбензол образует магнийорганическое соединение C6 F5 MgCl, широко используемое в органическом синтезе.
Перфторолефины, в отличие от олефинов, являющихся нуклеофилами, резко электрофильны. Они легко реагируют с различными нуклеофилами (см. Нуклеофильные и электрофильные реагенты ), причём в зависимости от типа последних образуются продукты присоединения или замещения атома F в винильном (а ) или аллильном (б ) положении на остаток нуклеофила (Nu):
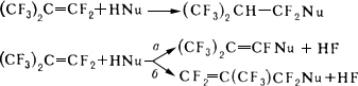
Электрофильные соединения реагируют с фторолефинами значительно труднее, чем с их углеводородными аналогами. Однако фторолефины присоединяют галогены, смешанные галогены, серный ангидрид и др. сильные электрофильные реагенты. Перфторолефины легко вступают в радикальные реакции, например
CF2 = CF2 + N2 O4 ® CF2 NO2 — CF2 NO2 + CF2 NO2 — CF2 ONO,
легко полимеризуются и сополимеризуются (см. Фторопласты , Фторкаучуки ). При окислении j-олефинов в щелочной среде образуются j-окиси (см. ниже).
Монофторметанол — нестойкая жидкость, t kип 51°C; ди- и трифторметанолы не получены, но известны производные трифторметанола: трифторметилгипофторит CF3 OF — газ, t kип — 95°C, и алкоголяты CF3 OK и CF3 OCs. Фторзамещённые спирты (b-, g-, но не a-) — устойчивые, легко перегоняющиеся жидкости. Кислотные свойства спиртов усиливаются по мере накопления атомов фтора.
С увеличением содержания фтора в молекулах альдегидов и кетонов электрофильность карбонильного атома углерода резко усиливается. Перфторальдегиды и перфторкетоны, подобно хлоралю, образуют стойкие геминальные диолы, например CF3 —CH (OH)2 , CF3 —C (OH)2 —CF3 , и полуацетали; легче, чем их углеводородные аналоги, присоединяют NH3 , HCN, NH2 OH и др. нуклеофильные реагенты; легко подвергаются распаду с образованием фтороформа, например:
CF3 COCF3 + NaOH ® CF3 H + CF3 COONa.
Частично фторированные кетоны и альдегиды характеризуются высоким содержанием енольных форм (см. Таутомерия ), склонных к образованию внутрикомплексных соединений; это свойство их используется для разделения редких и рассеянных элементов, например с помощью теноилтрифторацетона выделяют и очищают Be, Со, Hf, Zr, Ас, а также радиоактивные изотопы, образующиеся в ядерном реакторе.