Белки (грызуны)
Бе'лки (Sciurus), род млекопитающих семейства беличьих отряда грызунов. Распространены в лесах Европы, Азии и Америки. Около 50 видов. Приспособлены к древесному образу жизни. Длина тела до 28 см. Мех обычно густой, у некоторых пушистый. Окраска варьирует от ярко-рыжей до серой и чёрной, многие виды окрашены пёстро. В СССР 2 вида: обыкновенная Б. и персидская Б. Обыкновенная Б. (S. vulgaris) распространена в лесной и лесостепной зоне на С. до лесотундры. Наиболее многочисленна в темнохвойной и лиственной тайге и в смешанных лесах. Питается семенами хвойных пород, желудями, орехами, ягодами, иногда насекомыми и яйцами птиц. На зиму делает запасы. Ведёт дневной образ жизни. Строит на деревьях из лишайников, мха, луба и веточек гнёзда (гайна) или поселяется в дуплах. Обычно 2 (иногда 3) выводка в год (по 5—10 бельчат). Численность зависит от урожая семян хвойных пород; в голодные годы предпринимают массовые перекочёвки. Один из основных объектов пушного промысла в СССР (таёжная зона Европейской части, Урала и Сибири).
Персидская Б. (S. anomalus) встречается в лесных районах Закавказья; вследствие малочисленности и редкого грубого меха промыслового значения не имеет.
Лит.: Огнев С. И., Звери СССР и прилежащих стран, т. 4 — Грызуны, М.—Л., 1940; Наумов С. П. и Лавров Н. П., Биология промысловых зверей и птиц СССР, М., 1948; Млекопитающие фауны СССР. М.—Л., 1963.

Обыкновенная белка.
Белки (название горных вершин в Сибири)
Белки', название горных хребтов и вершин в Сибири, главным образом на Алтае (например, Катунские Б.) и в Восточных Саянах (например, Агульские Б.) поднимающихся выше границы леса и покрытых снегом в течение всего или большей части года. Иногда подобного вида вершины и хребты носят название белогорий (например, Манское белогорье в Восточных Саянах).
Белки (протеины)
Белки', протеины, высокомолекулярные природные органические вещества, построенные из аминокислот и играющие фундаментальную роль в структуре и жизнедеятельности организмов. Именно Б. (ферменты и др.) осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Б. входят в состав сложных клеточных структур — органелл. И хотя органеллы содержат также другие вещества (липиды , углеводы , нуклеиновые кислоты , неорганические компоненты), Б. особенно важны; они — основные структурообразователи и играют ведущую роль в выполнении физиологических функций. Например, благодаря соответствующей организации различного рода Б. биологические мембраны , покрывающие клетки, активно (с затратой энергии) переносят в клетку или из клетки определённые молекулы и ионы. В частности, транспорт катионов создаёт электрическую поляризацию, необходимую для процессов возбуждения . В двигательных аппаратах — мышечных волокнах и других — комплексы специфических Б. осуществляют сокращение, превращая химическую энергию в механическую работу. Деятельность Б. во многом связана с разными небелковыми веществами, из которых наибольшее биологическое значение имеют нуклеиновые кислоты. Однако решающим фактором молекулярных механизмов всех активных проявлений жизнедеятельности являются Б. В этом смысле подтверждено и детализировано известное положение Ф. Энгельса о Б. как основе биологической формы движения материи (см. «Анти-Дюринг», 1966, с. 78). Молекулы Б. в структурном отношении бесконечно разнообразны — жёсткость и точность уникальной организации сочетаются в них с гибкостью и пластичностью (см. ниже Структура Б.). Всё это создаёт необозримые функциональные потенции; поэтому Б. и явились тем исключительным материалом, который послужил основой возникновения жизни на Земле. Б. — один из основных продуктов питания человека и животных (см. Белковые корма ), они служат источником восстановления и обновления цитоплазмы клеток, образования ферментов, гормонов и др. (см. Белковый обмен ).
Физико-химические свойства Б. Молекулы Б. имеют массу от десятков тыс. до 1 млн. и выше. Так, фермент рибонуклеаза имеет молекулярную массу 12 700, дыхательный пигмент улитки гемоцианин — 6 600 000. Элементарный состав большинства Б.: 50,6—54,5% углерода, 6,5—7,3% водорода, 21,5—23,5% кислорода, 15—17,6% азота, 0,3—2,5% серы; в состав ряда Б. входит и фосфор. Сведения о молекулярной массе и ряде свойств молекул Б. можно получить, исследуя их осаждение (седиментацию) в ультрацентрифуге, диффузию, вязкость, растворимость и светорассеяние. Все Б. с очень большой молекулярной массой построены из более мелких частиц — субъединиц. Растворимые Б. — гидрофильные коллоиды , активно связывающие воду; их растворы обладают значительной вязкостью, низким осмотическим давлением. Молекулы Б. не проходят через полупроницаемые мембраны, обладают слабой способностью к диффузии. Б. — амфотерные электролиты , т.к. имеют свободные карбоксильные (кислотные) и аминные (основные) группы. Изоэлектрическая точка различных Б. неодинакова: для альбумина плазмы крови она равна 4,7, для зеина кукурузы 6,2. Б. имеют электрический заряд, изменяющийся в зависимости от структуры Б. и реакции среды. В электрическом поле растворённые Б. движутся (электрофорез ), причём направление и скорость движения неодинаковы для различных Б. Растворимость Б. варьирует не меньше, чем другие их свойства. Одни Б. легко растворяются в воде, другие требуют для растворения небольших концентраций солей, третьи переходят в раствор только под воздействием сильных щелочей и т.п. Из растворов Б. неодинаково осаждаются органическими веществами (например, спиртами) или высокими концентрациями солей (высаливаются). Существенные различия в растворимости и других свойствах используются при выделении индивидуальных Б. из тех сложных систем, в которых они встречаются в природе. После очистки многие Б. способны кристаллизоваться.
Структура Б. Белок всех организмов состоит из 20 видов аминокислот. Каждый Б. характеризуется определённым ассортиментом и количественным соотношением аминокислот. В молекулах Б. аминокислоты соединены между собой пептидными связями (—СО—NH—) в линейной последовательности (рис. 1 ), составляющей так называемую первичную структуру Б.
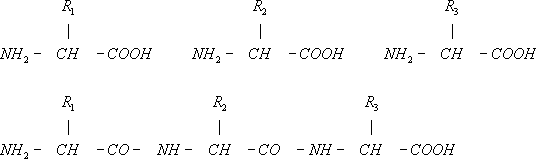
Аминокислотные (полипептидные) цепи, содержащие аминокислоту цистин, в местах его расположения скреплены дисульфидными связями (—S—S—). Между аминокислотами в Б., как правило, не существует иных химических связей, кроме пептидных и дисульфидных. Для каждого Б. не только состав, но и последовательность аминокислот в полипептидной цепи — первичная структура — строго индивидуальны; любое звено цепи — вполне определённая аминокислота. Все многочисленные виды Б., существующие в природе, различаются по первичной структуре; потенциально возможное их число практически неограниченно. Индивидуальная первичная структура каждого Б. сохраняется в поколениях благодаря точной передаче соответствующей наследственной информации (см. ниже Биосинтез Б.). Для анализа первичной структуры Б. разработаны специальные методы. При переваривании определёнными ферментами, например трипсином, каждый Б. даёт свой набор фрагментов (пептидов). При соответствующем их разделении на листе бумаги получается «пептидная карта», которая, подобно отпечатку пальца, характерна для данного Б. Разделение на пептиды и определение строения каждого из них в отдельности — основной путь расшифровки первичной структуры Б.