Э. п. находят применение в радиотехнике, автоматике, связи, вычислительной технике, астрономии, физике, медицине и т. д, — практически во всех областях науки и техники. Мировая промышленность ежегодно выпускает (70-е гг.) свыше 10 млрд. Э. п. различных наименований.
Лит.: Власов В. Ф., Электронные и ионные приборы, 3 изд., М., 1960; Кушманов И. В., Васильев Н. Н., Леонтъев А. Г., Электронные приборы, М., 1973.
В. Ф. Коваленко
Электронные призмы
Электро'нные при'змы, электроннооптические (соответственно ионные призмы — ионнооптические) системы, предназначенные для отклонения пучков заряженных частиц или для разделения таких частиц по энергии и массе. Э. п. получили своё название в рамках общей аналогии между электронной и ионной оптикой и оптикой световых лучей. Среди многочисленных типов Э. п. наиболее близкими аналогами светооптических призм являются те Э. п., которые оставляют падающий на них параллельный пучок заряженных частиц параллельным и после отклонения. Простейшей электростатической Э. п. такого типа служит телескопическая система, составленная из двух цилиндрических иммерсионных электронных линз (рис. 1 ). Задний линейный фокус АВ первой линзы совпадает с передним линейным фокусом второй. Электростатическое поле телескопической системы «двухмерно» (оно не изменяется в направлении, параллельном оси х ) и симметрично относительно средней плоскости ху, вблизи которой движутся частицы. Параллельный пучок падает на телескопическую систему под большим углом J1 к оси у и выходит под углом J2 , сохраняя свою параллельность. При этом выполняется равенство
sin J2 / sin J1 =
где V1 — потенциал первого участка Э. п. и пространства перед ним, V2 — потенциал последнего участка призмы и пространства за ним. Как известно, потенциал электростатический можно определять с точностью до произвольной постоянной, принимая его равным нулю там, где это диктуется соображениями удобства. В данном случае, как и в большинстве задач электронной и ионной оптики, потенциал принимают равным нулю там, где равна нулю скорость частиц. При этом условии электроннооптический преломления показатель nэ =
В магнитной Э. п. с «двухмерным» полем роль цилиндрических линз играют поля рассеяния на краях магнитных полюсов. При определённом угле падения пучка на призму эти поля образуют телескопическую систему (рис. 2 ).
Лит.: Арцимович Л. А., Лукьянов С. Ю., Движение заряженных частиц в электрических и магнитных полях, М., 1972; Кельман В. М., Явор С. Я., Электронная оптика, 3 изд., Л., 1968; Призменные бета-спектрометры и их применение, Вильнюс, 1971; Применение призменных бета-спектрометров, Вильнюс, 1974.
В. М. Кельман, И. В. Родникова.
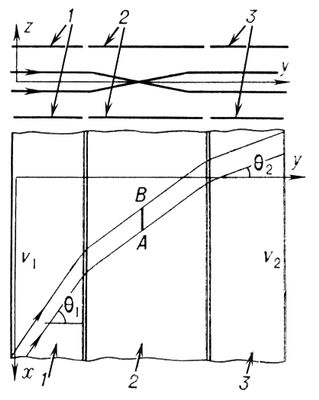
Рис. 1. Телескопическая система, состоящая из двух цилиндрических иммерсионных электростатических линз: 1, 2 - электроды, составляющие первую по ходу пучка цилиндрическую линзу, 2, 3 - вторую линзу; ломаные линии со стрелками - проекции траекторий заряженных частиц на плоскости yz и ху; А В- линейный фокус. (Название «цилиндрический» применительно к электронным линзам указывает на то, что они могут действовать на электронный пучок так же, как цилиндрическая светооптическая линза на световой пучок.)
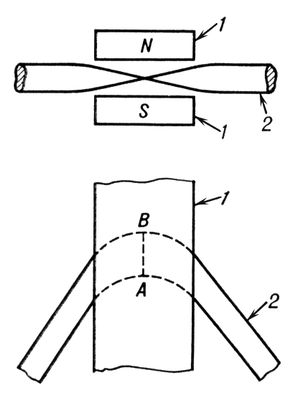
Рис. 2. Отклонение пучка заряженных частиц магнитной призмой: 1 — полюса магнита призмы; 2 — пучок заряженных частиц; АВ — линейный фокус.
Электронные теории в органической химии
Электро'нные тео'рии в органи'ческой хи'мии, теории, рассматривающие строение, физические свойства и реакционную способность органических соединений на основе представлений о распределении электронной плотности в атомах и молекулах, а также о смещениях её при химических реакциях.
Э. т. возникли на рубеже 19 и 20 вв. вскоре после открытия электрона. В первых Э. т. представления о существовании электростатических связей в неорганических соединениях были механически перенесены на неполярные органические соединения. Эти теории не смогли объяснить многие экспериментальные факты органической химии и потому уступили место теориям, базирующимся на представлениях о существовании ковалентных связей (немецкий учёный И. Штарк, 1908—15, Г. Льюис , 1916—23). Образование ковалентной связи, осуществляемое, по Льюису, общей для двух атомов электронной парой (дублетом), впоследствии было интерпретировано в рамках квантовой механики как эффект перекрывания электронных плотностей взаимодействующих атомов (см. Химическая связь , Валентность ).
Концепция ковалентной связи оказалась наиболее плодотворной в органической химии. Созданными в 20—30-е гг. на её основе Э. т. было объяснено строение большого числа органических соединений и установлена зависимость между свойствами этих соединений и их строением, чему способствовали появившиеся в это время квантовохимического представления о различных типах ковалентной связи (см. Сигма- и пи-связи , Семиполярная связь ).
Наибольшее распространение в этот период получили используемые и поныне Э. т., развивавшиеся английскими химиками Т. Лоури, Р. Робинсоном , К. Инголдом , а также Л. Полингом . Введённые ими в рамках так называемой теории электронных смещений представления о статическом и динамическом смещениях электронных пар (индуктивный, мезомерный, индуктомерный и электромерный эффекты) широко используются для объяснения, а в некоторых случаях и для предсказания свойств и реакционной способности разнообразных органический соединений. Английские химики предложили также классификацию органических реакций в соответствии с механизмом электронных смещений и механизмом электростатической ориентации реагентов при их взаимодействии — нуклеофильным, электрофильным и радикальным (см. Органическая химия , Сопряжение связей , Мезомерия , Нуклеофильные и электрофильные реагенты ). Теория электронных смещений позволила объяснить выравнивание связей в цепях сопряжения (в частности, равноценность связей в бензоле), передачу влияния заместителя по системе сопряжённых связей, порядок замещения в ароматическом кольце при наличии в нём заместителя (см. Ароматические соединения , Ориентации правила ) и многие другие закономерности, экспериментально установленные в органической химии, например Марковникова правило , Эльтекова правило .