Ферма (технич.)
Ферма' (франц. ferme, от лат. firmus – крепкий, прочный), несущая конструкция, состоящая из прямолинейных стержней, узловые соединения которых при расчёте условно принимаются шарнирными. Ф. применяют главным образом в строительстве (покрытия зданий, пролётные строения мостов, мачты, опоры линий электропередачи, гидротехнические затворы и др.), а также в качестве несущих конструкций машин и механизмов. По виду материала различают металлические, железобетонные, деревянные и комбинированные (например, металлодеревянные) Ф. Тип Ф. и её очертания (рис. ) определяются назначением здания или сооружения, видом покрытия, способом опирания Ф. и т.д. Узлы Ф., хотя и считаются шарнирными, практически обладают той или иной степенью жёсткости. При проектировании Ф., как правило, обеспечивается узловое приложение внешней нагрузки (например, прогоны покрытия здания опираются на Ф. в узлах верхнего пояса, балки подвесных кранов крепятся к узлам нижнего пояса и т.д.). Допущения о шарнирном соединении узлов и узловом приложении нагрузки позволяют учитывать при расчёте Ф. только осевые продольные усилия в стержнях (при этом в поперечных сечениях стержней возникают равномерно-распределённые напряжения, позволяющие наиболее эффективно использовать материал). Усилия в стержнях статически определимых плоских Ф. (см. Статически определимая система ) определяют из уравнений статики, пространственных – как правило, путём расчленения на плоские. Статически неопределимые Ф. (см. Статически неопределимая система ) рассчитывают при помощи уравнений метода сил (см. Строительная механика ), в которых коэффициенты при неизвестных (перемещения) определяют с учётом действия только нормальных усилий в элементах Ф. При расчёте Ф. на подвижные нагрузки используют т. н. линии влияния.
Лит. см. при статьях Строительная механика , Металлические конструкции , Железобетонные конструкции и изделия , Деревянные конструкции .
Л. В. Касабьян.
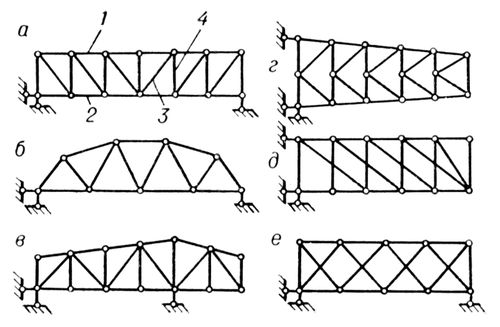
Классификация ферм по типам решётки: а — балочная раскосная; б — балочная с треугольной решёткой; в — балочно-консольная с треугольной решёткой и дополнительными стойками; г — консольная полураскосная; д — консольная двухраскосная; е — балочная двухрешётчатая; 1 — верхний пояс; 2 — нижний пояс; 3 — раскос; 4 — стойка.
Фермана
Фермана' (Fermanagh), административный округ в Северной Ирландии (Великобритания), в бассейне озёр Лох-Эрн и Аппер-Лох-Эрн. Площадь 1,7 тыс. км 3 . Население 50,3 тыс. чел. (1971). Главный город – Эннискиллен. Сельскохозяйственный район (мясо-молочное животноводство).
Фермата
Ферма'та (итал. fermata, буквально – остановка) (музыкальная), знак ( или ) в нотном письме, обозначающий продление ноты или паузы, над или под которой он стоит, на неопределённое время (обычно в 11 /2 —2 раза). Продолжительность звука или паузы с Ф. исполнитель определяет по собственному усмотрению. Ф. над тактовой чертой обозначает неопределенной продолжительности паузу.
Ферментативные методы анализа
Ферментати'вные ме'тоды ана'лиза , методы количественного определения химических веществ в растворе, основанные на использовании ферментов . С помощью Ф. м. а. определяют вещества, способные участвовать в химических реакциях, катализируемых ферментами, а также являющиеся активаторами либо ингибиторами ферментов. Ф. м. а. характеризуются высокой чувствительностью и специфичностью, поскольку ферменты катализируют превращения веществ с большой скоростью и высоко избирательно, даже если анализируемое соединение находится в смеси с др. близкими по химическому строению веществами.
При определении субстрата ферментативной реакции к анализируемой пробе прибавляют фермент и др. необходимые для реакции компоненты. По окончании реакции тем или иным удобным методом устанавливают в растворе содержание продукта реакции. Например, определение этилового спирта в растворе с помощью фермента алкогольдегидрогеназы (АДГ) производится при участии кофермента АДГ – никотинамидадениндинуклеотида (НАД). Последний в ходе ферментативной реакции количественно превращается в восстановленный НАД, обладающий, в отличие от окисленной формы, способностью к поглощению ультрафиолетового света при длине волны 340 нм. Измеряя это поглощение, можно установить концентрацию восстановленного НАД и рассчитать концентрацию этилового спирта. Метод позволяет определить 1 мкг спирта в 1 мл раствора. Многие Ф. м. а. основаны на определении изменения кислотности раствора в ходе ферментативной реакции. Например, эфиры карбоновых, фосфорной и др. кислот можно определять с помощью специфических ферментов, катализирующих их гидролиз. Поскольку при гидролизе образуются соответствующие кислоты, результат их титрования по окончании реакции позволяет рассчитать концентрацию определяемого эфира.
При Ф. м. а. часто используют комбинацию (сопряжение) нескольких ферментативных реакций. Например, концентрация глюкозы может быть определена с помощью ферментов глюкозооксидазы (ГО) и пероксидазы (ПО). Под действием ГО глюкоза превращается в глюконовую кислоту, при этом образуется перекись водорода, которая, в свою очередь, под влиянием ПО может окислить введённый в раствор ортодианизидин (или толидин) и давать окраску. Измеряя интенсивность окраски раствора, можно рассчитать исходную концентрацию глюкозы (чувствительность метода 5 мкг в пробе). Этот способ применяется для быстрого определения глюкозы в моче у больных диабетом с помощью индикаторной бумажки, пропитанной указанными реактивами.
Разновидностью Ф. м. а. являются кинетические методы анализа, основанные на зависимости скорости ферментативной реакции от концентрации анализируемых веществ (см. Ферментативный катализ ), которыми могут быть субстраты, активаторы или ингибиторы ферментов. Зная характер этой зависимости, можно, измеряя скорость ферментативной реакции, рассчитать концентрацию анализируемого вещества. Например, количественное определение фосфорорганических инсектицидов, являющихся сильными ингибиторами, фермента холинэстеразы производится путём измерения активности этого фермента в отсутствии и в присутствии ингибитора. Чувствительность метода определения, например диэтил-пара -нитрофенилфосфата, составляет 0,015 мкг в пробе, ионов магния (по активирующему их влиянию на фермент, окисляющий изолимонную кислоту) – 0,1 мкг.
Широкое распространение получили Ф. м. а., основанные на использовании ферментов, прочно связанных с твёрдыми носителями, которыми могут быть полимеры, неорганические сорбенты, гели. Такие «твёрдые ферменты», помещенные на электрохимические датчики (стеклянные, платиновые и др. электроды), представляют собой ферментные электроды, служащие инструментами для измерения скорости ферментной реакции в растворе анализируемого вещества. С помощью ферментных электродов определяют мочевину, аминокислоты, пенициллин, глюкозу и т.д. с чувствительностью 0,1–0,01 мкг в пробе.
Лит.: Березин И. В., Клесов А. А., Ферментные электроды, «Успехи химии», 1976, т. 45, в. 2: Methoden der enzymatische Analyse, Hrsg. Н. U. Bergmeyer, 3 Aufl., Bd 1–2, Weinheim, 1974.