Химические связи в М. подавляющего числа органических соединений являются ковалентными. Напротив, в ряде неорганических соединений существуют ионные, а также донорно-акцепторные связи (см. Химическая связь ), реализуемые в результате обобществления неподелённой пары электронов данного атома. Энергия образования М. из атомов во многих рядах сходных соединений приближённо аддитивна. Иными словами, в этих случаях можно считать, что энергия М. есть сумма энергии её связей, имеющих постоянные значения в рассматриваемом ряду. Отсюда следует практическая возможность приписать химическим связям приближённо автономные электронные оболочки.
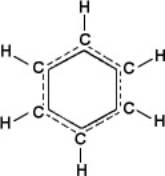
Аддитивность энергии М. выполняется не всегда. Яркий пример нарушения аддитивности представляют плоские М. органических соединений с т. н. сопряжёнными связями, т. е. с кратными связями, чередующимися с единичными. В этих случаях валентные электроны, определяющие кратность связей, т. н. p-электроны, становятся общими для всей системы сопряжённых связей, делокализованными. Такая делокализация электронов приводит к дополнительной стабилизации М. Например, энергия образования М. 1,3-бутадиена Н2 С=CH—CH=CH2 больше ожидаемой по аддитивности на 16,8 кдж/моль (на 4 ккал/моль ). Выравнивание электронной плотности вследствие обобществления p-электронов по связям выражается в удлинении двойных связей и укорочении единичных. В правильном шестиугольнике межуглеродных связей и бензола (см. формулу) все связи одинаковы и имеют длину, промежуточную между длиной единичной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах (см. ниже).
Современная квантовомеханическая теория химической связи учитывает частичную делокализацию не только p-, но и s-электронов, наблюдающуюся в любых молекулах. Вообще говоря, это не нарушает аддитивности энергий молекул.
В подавляющем большинстве случаев суммарный спин валентных электронов в М. равен нулю, т. е. спины электронов попарно насыщены. М., содержащие неспаренные электроны — радикалы свободные (например, атомный водород Н· · , метил CH·· 3 ), обычно неустойчивы, т. к. при их соединении друг с другом происходит значительное понижение энергии вследствие образования валентных связей. Наиболее эффективным методом изучения строения свободных радикалов является электронный парамагнитный резонанс (ЭПР).
Электрические и оптические свойства молекул. Поведение вещества в электрическом поле определяется основными электрическими характеристиками М. — постоянным дипольным моментом и поляризуемостью. Дипольный момент означает несовпадение центров тяжести положительных и отрицательных зарядов в М., т. е. электрическую асимметрию М. Соответственно М., имеющие центр симметрии, например H2 , лишены постоянного дипольного момента; напротив, в HCl электроны смещены к атому Cl и дипольный момент равен 1,03 D (1,03×10-18 ед. СГС). Поляризуемостью характеризуется способность электронной оболочки любой М. смещаться под действием электрического поля, в результате чего в М. создаётся индуцированный дипольный момент. Значения дипольного момента и поляризуемости находят экспериментально с помощью измерений диэлектрической проницаемости . В случае аддитивности свойств М. дипольный момент М. может быть представлен суммой дипольных моментов связей (с учётом их направления), то же относится к поляризуемости М.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны — тем самым они определяются поляризуемостью М. вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой — разделом физической оптики, посвященным изучению оптических свойств вещества.
Магнитные свойства молекул. М. и макромолекулы подавляющего большинства химыических соединений диамагнитны (см. Диамагнетизм ). Магнитная восприимчивость М. (c) в ряде органических соединений может быть выражена как сумма значений c для отдельных связей; однако аддитивность c выполняется хуже, чем аддитивность поляризуемостей a. И c, и a определяются свойствами внешних электронов М.; эти две величины связаны одна с другой.
Парамагнитны М., обладающие постоянным магнитным моментом (см. Парамагнетизм ). Таковы М. с нечётным числом электронов во внешней оболочке (например, NO и любые свободные радикалы), М., содержащие атомы с незамкнутыми (незаполненными) внутренними оболочками (переходные металлы и др.). Магнитная восприимчивость парамагнитных веществ зависит от температуры, т. к. тепловое движение препятствует ориентации магнитных моментов в магнитном поле. Строение парамагнитных М. эффективно изучается методом ЭПР.
Атомные ядра элементов, у которых атомный номер или массовое число нечётны, обладают ядерным спиновым парамагнетизмом. Для таких ядер характерен ядерный магнитный резонанс (ЯМР), спектр которого зависит от электронного окружения ядер в М. Поэтому спектры ЯМР служат источником очень подробной информации о строении М., в том числе и весьма сложных, например белков (см. также Ядерный квадрупольный резонанс , Магнетизм , Магнетохимия ).
Спектры и строение молекул. Электрические, оптические, магнитные и другие свойства М. в конечном счёте связаны с волновыми функциями и энергиями различных состояний М.; через них выражаются и электрический дипольный момент, и магнитный момент, и поляризуемость, и магнитная восприимчивость. Прямую информацию о состояниях М. и вероятностях перехода между ними дают молекулярные спектры .
Частоты в спектрах, соответствующих вращательным переходам, зависят от моментов инерции М., определение которых из спектроскопических данных позволяет получить наиболее точные значения межатомных расстояний в М.
Общее число линий или полос в колебательном спектре М. зависит от её симметрии. Частоты колебаний, наблюдаемые в спектрах, определяются, с одной стороны, массами атомов и их расположением, с другой — динамикой межатомных взаимодействий. Теория колебаний многоатомных М. соответственно опирается на теорию химического строения и классическую механику связанных колебаний. Исследование колебательных спектров позволяет сделать ряд выводов о строении М., о межатомных и межмолекулярных взаимодействиях, изучать явления таутомерии, поворотной изомерии.
Электронные переходы в М. характеризуют структуру их электронных оболочек, состояние химических связей. Спектры М., обладающих большим числом сопряжённых связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, построенные из таких М., обладают цветностью, к ним относятся все органические красители. Изучение электронно-колебательных спектров М. необходимо для понимания естественной и магнитной оптической активности.
Молекулы в химии, физике и биологии. Понятие о М. — основное для химии, и большей частью сведений о строении и функциональности М. наука обязана химическим исследованиям. При химической реакции происходит превращение одних М. в другие. Для такого превращения обычно необходима некоторая избыточная энергия М. — энергия активации (см. Кинетика химическая ). В акте химического взаимодействия М. проходят через конфигурацию т. н. активированного комплекса, или переходного состояния М. Характер и скорость химической реакции определяются этим состоянием, в свою очередь зависящим от строения взаимодействующих М. Химия решает две главные задачи, относящиеся к М., — устанавливает строение М. на основании химических реакций и, наоборот, на основе строения М. определяет ход реакций. Широкая совокупность важнейших проблем современной химии, в том числе и нерешённых, сводится к теории химической реакционной способности. Исследование этих проблем требует применения как теоретических методов квантовой химии, так и экспериментальных данных, получаемых химическими и физическими методами.